醫材設計方法論(2)-風險管理與設計輸入&觀念
這裡會不斷對ISO法範提出個人看法,這類ISO規範,其實是經過專家們在長年的經驗下不斷的修正下,歸納出個有邏輯,有系統的做事方式,讓相關產業有個依循的方式,確保開發或是製作出來的產品有一定的保障
除了是必須遵循的規範外,但個人將其視為一個系統化的做事方式,對產品的開發有相當的助益
很多朋友遇到法規,最頭痛的是冗長的外文,這裡建議,如果要快速掌握內容核心,可試著找到該法規的流程圖如下圖,其可視為本法規的精要思想,由此架構串連所有的內容
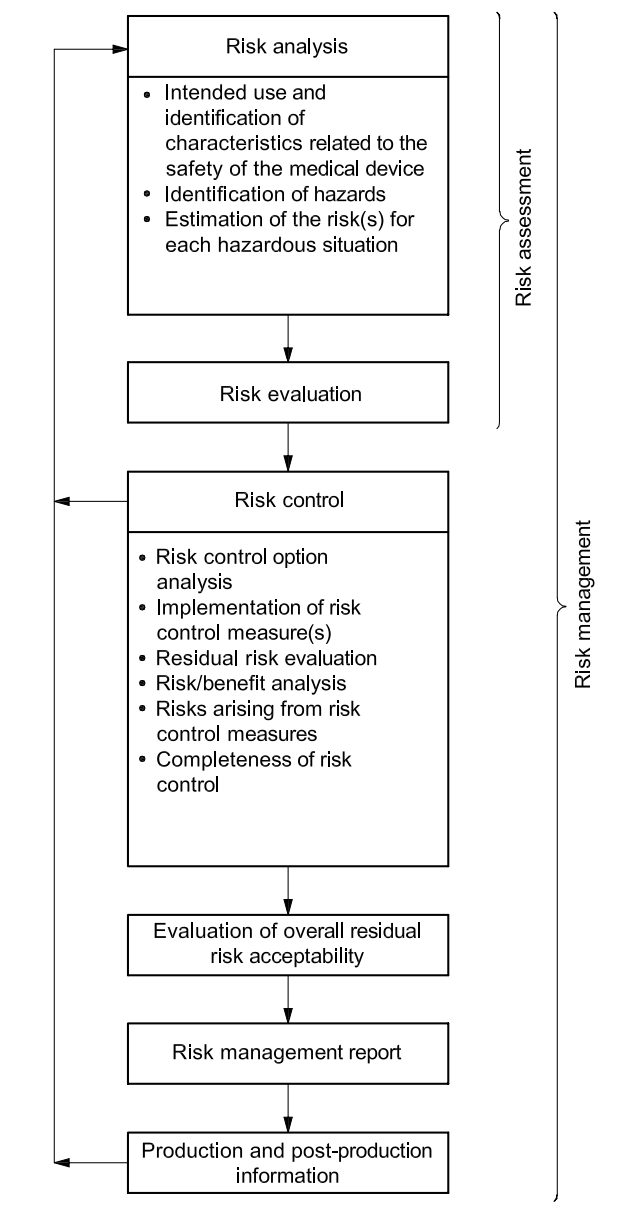
在討論風險管理之前,請先記住風險(Risk)是由傷害(Harm)與機率(Probability)所構成
風險評鑑
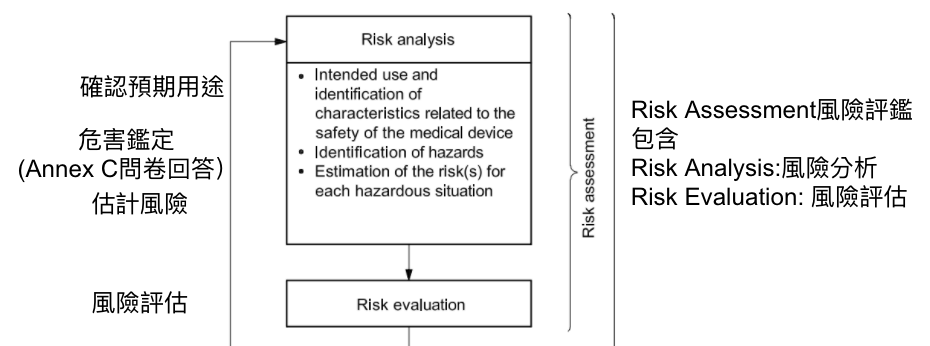
在醫材開發,起手式就是確認預期用途,預期用途訂定後,在ISO14971的 Annex C有一連串的問卷,以問答的方式,導引開發者了解產品可能有的風險,以此協助下一步的危害鑒定,進而風險分析,也就是找出傷害程度大小,發生機率高低,前面的過程可視為風險分析(Risk Analysis)
下一步則是由分析出的傷害程度大小,發生機率高低(風險的2要素)就風險判斷條件,決定風險等級,也就是風險評估(Risk Evaluation)
以上的風險分析(Risk Analysis)與 風險評估(Risk Evaluation)過程形成了整個風險評鑑(Risk Assessment)

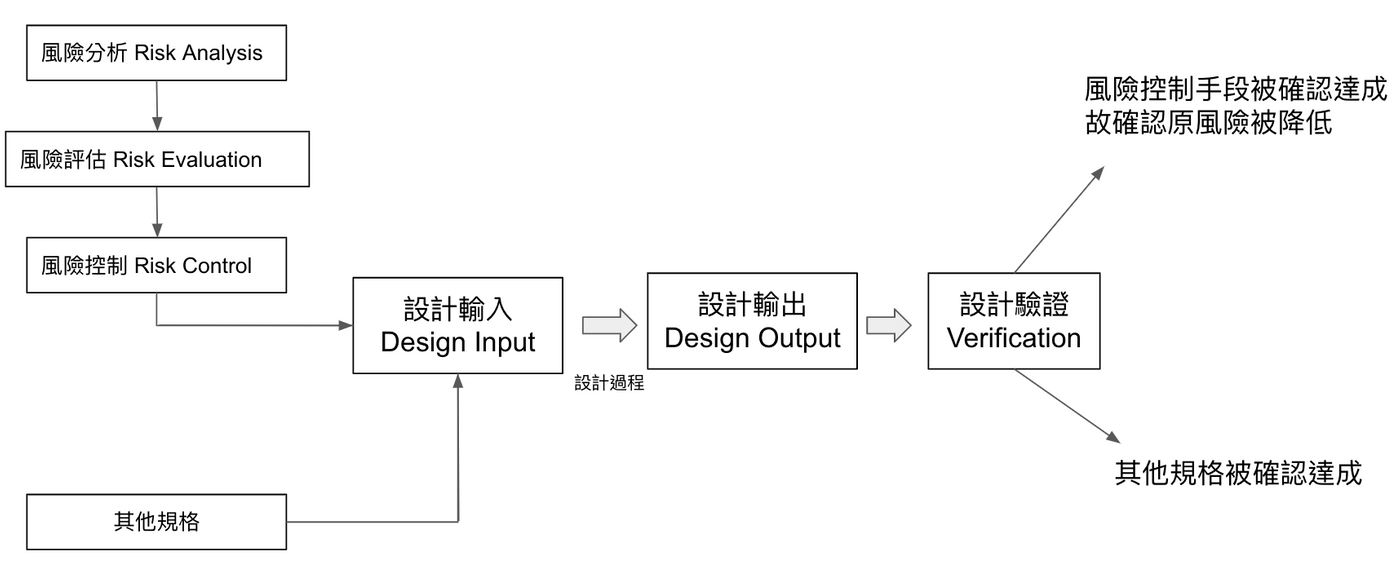
風險控制與設計輸入
根據風險評鑑(Risk Assessment)得出風險等級大小,以此列出優先提出風險控制對策

而風險對策導入其實就是設計輸入的一部分,如前所述,設計除了要列入法規要求的性能規格外,另外還有安全規格,而醫材注重安全性,所以風險管理是所有醫材要求的規範
就工程設計的角度,正規的作法是在設計之前,把所有的問題,要求,在設計輸入階段完整考慮,所以有些外商醫材公司,可以常見到一種文件product requirements document(PRD), 上面除了基本規格外,有的會有銷售區域的法規需求,甚至風險控制需求
此外,Usability也是在這個階段進行分析,先把可能遇到的問題,列入考慮,而後在formative evaluation進行分析,進而調整設計
設計輸出與驗證
其實這與後續的設計輸出有連貫性,把風險控制列入設計輸入後,當設計輸出完成驗證,也代表了風險控制的手段已被確認,進而確認風險減低有其根據,如下圖
小結
就個人觀察的實例,這類的作法在國外的小公司很輕易就能被實施,在於這是一個有系統化的做事方式,把這個理念視為作事的方法,則可以輕易被實施,
觀念其實決定了法規是否能在一個組織生根
把規範視為做事的方式絕對會比應付它來得輕鬆,甚至更有效率
喜欢我的作品吗?别忘了给予支持与赞赏,让我知道在创作的路上有你陪伴,一起延续这份热忱!

- 来自作者
- 相关推荐