AI/ML Framework與Pre-Cert Program差異探討

本文的目的在於藉由討論AI/ML Frameworkl與Pre-Cert Program( 軟體預先認證計畫)差異,提供以下資訊與討論
1.藉由差異的展示,讓讀者對這2個系統有更清楚的認識
2.更清楚了解FDA的思維,如TPLC
3.就個人觀察,未來有很多公司這兩類產品並存的機率很高,故探討如何設計一個設計流程管制機構能同時調和這2類軟體產品的需求
基本核心手法-TPLC
相對於目前的傳統的醫療軟體(SaMD),FDA對這兩類醫療軟體,採取更有彈性,但要求也更多的作法。
除了醫材管理基本精神-風險為本(Risks based approach)外,導入完整的產品生命週期管理會是進入下個世代管理的里程碑。
這個實現完整的產品生命週期管理的作法為TPLC(Total Product Life Cycle, 全產品生命週期)。
TPLC手法的特點在於可橫跨Premarket(上市前)及Postmarket(上市後)監控產品,並可評估產品面及組織面,所以就管理的層面而言,已相當完善。
但就不同產品的特質,TPLC過程的元件也會有不同。
TPLC元件與過程的不同
Fig 1 為Pre-cert Program的官方版本之TPLC手法介紹,而Fig2 為筆者製作的TPLC流程及元件全息圖
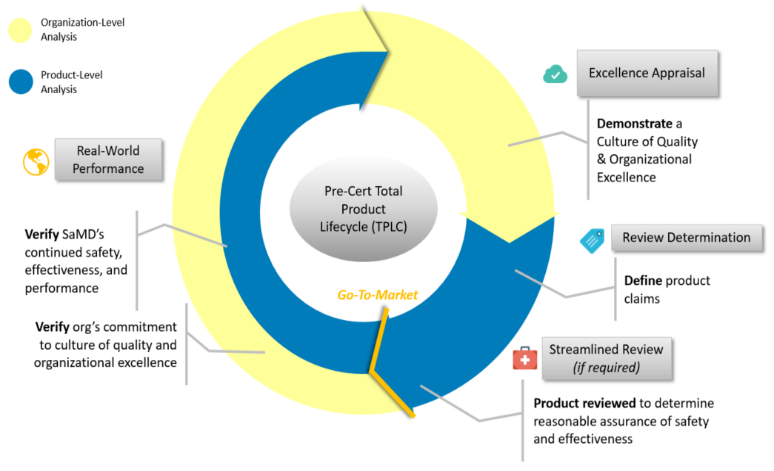
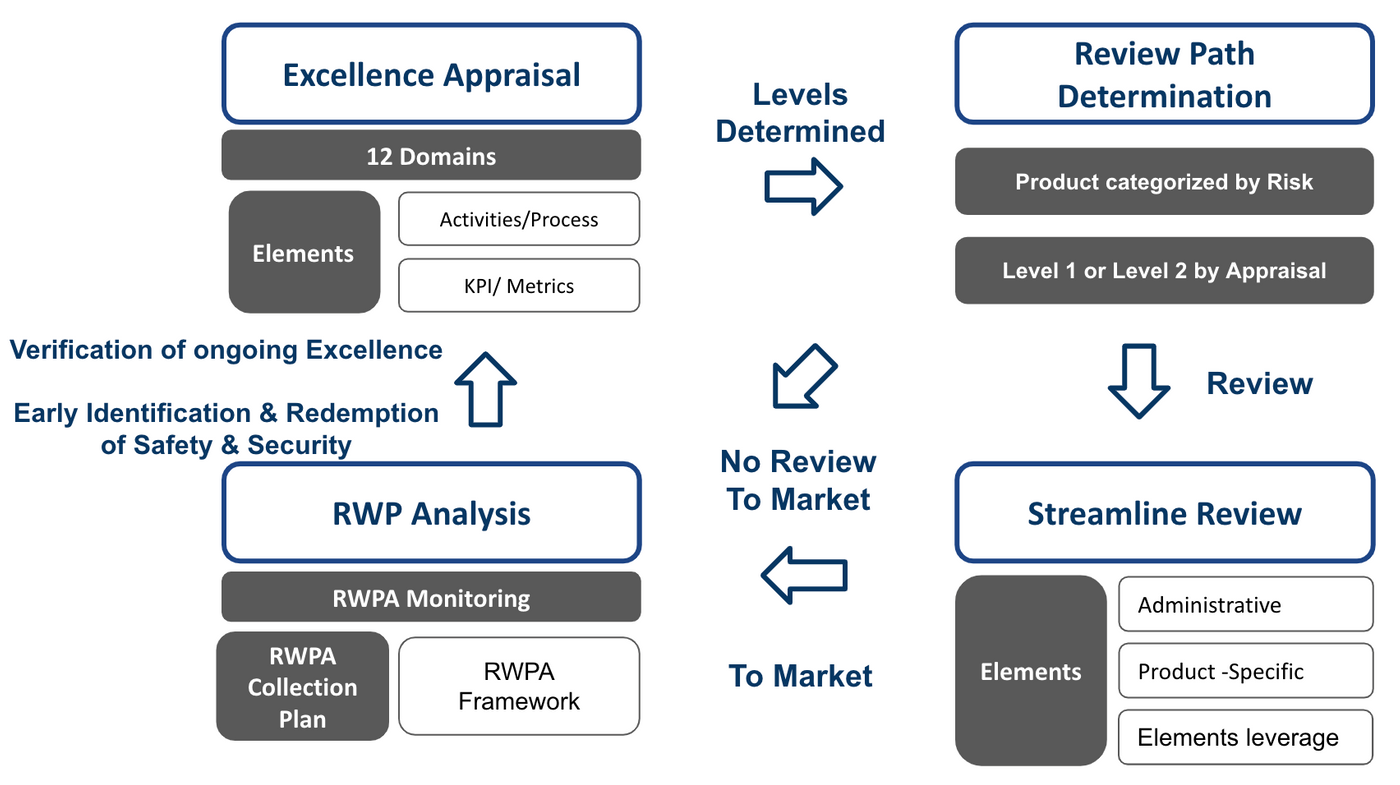
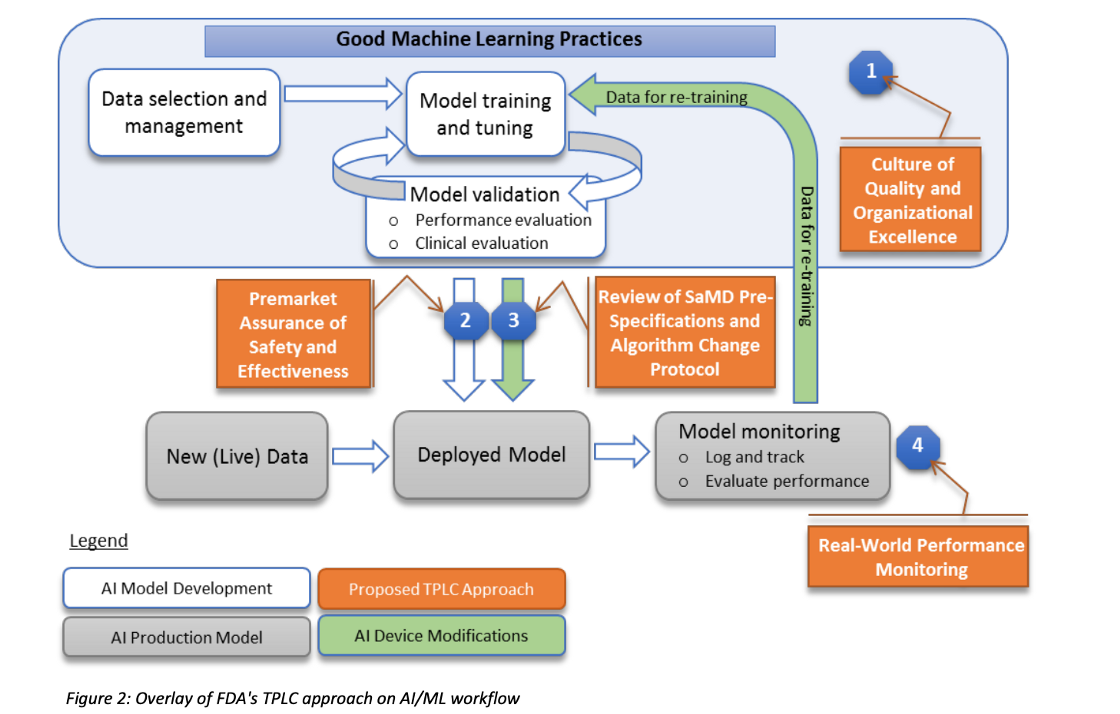
Fig 3,為AI/ML Framework的官方版本之TPLC手法介紹, Fig 4則為筆者整理出的流程元件全息圖。
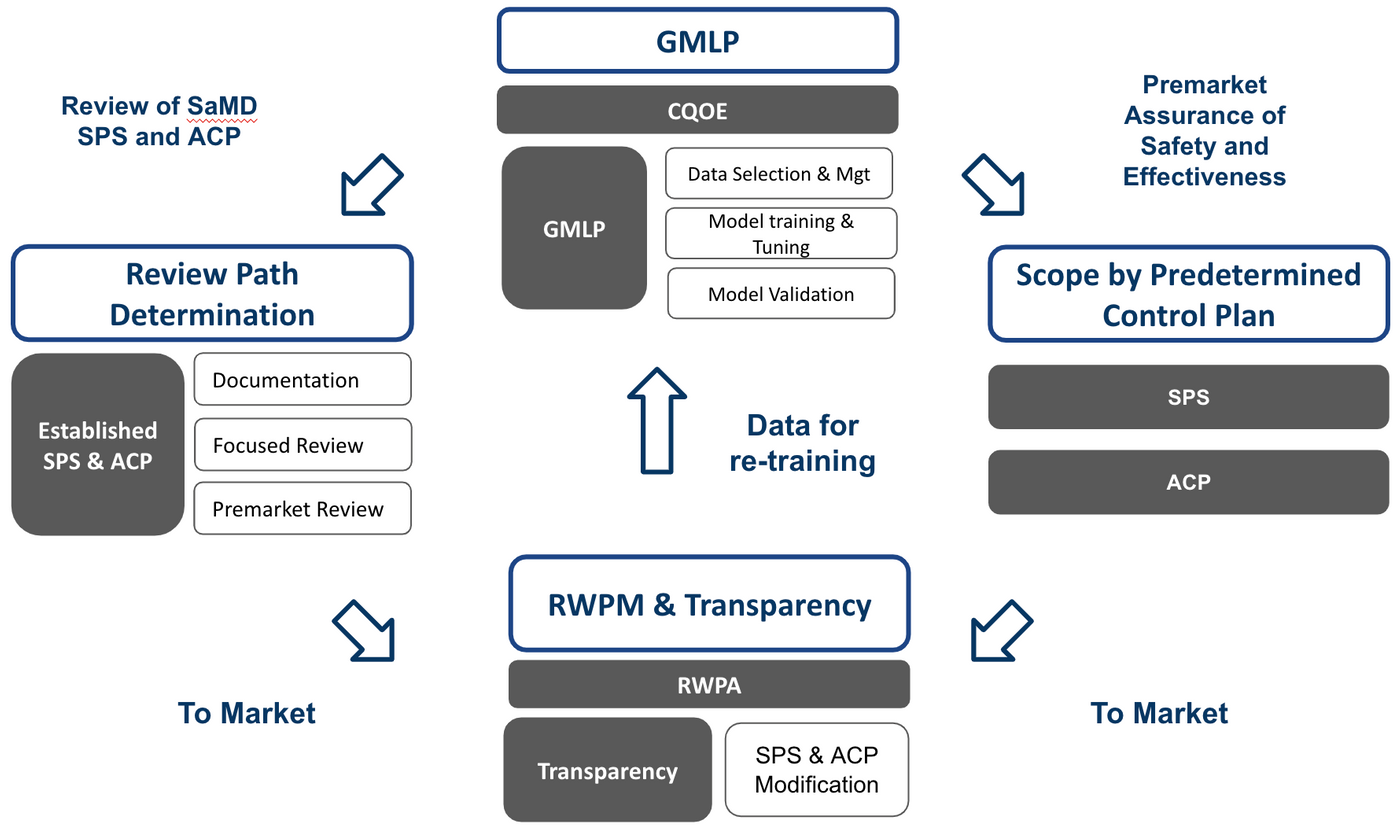
異同
最明顯的差異在於,Pre-Cert一個TPLC的週期,可能會經歷到3到4個步驟,而AI/ML不論那種狀態,則是只有經歷到3個步驟。
另外,因為產品的不同,所以產品面以及部份組織面的審查也不同。
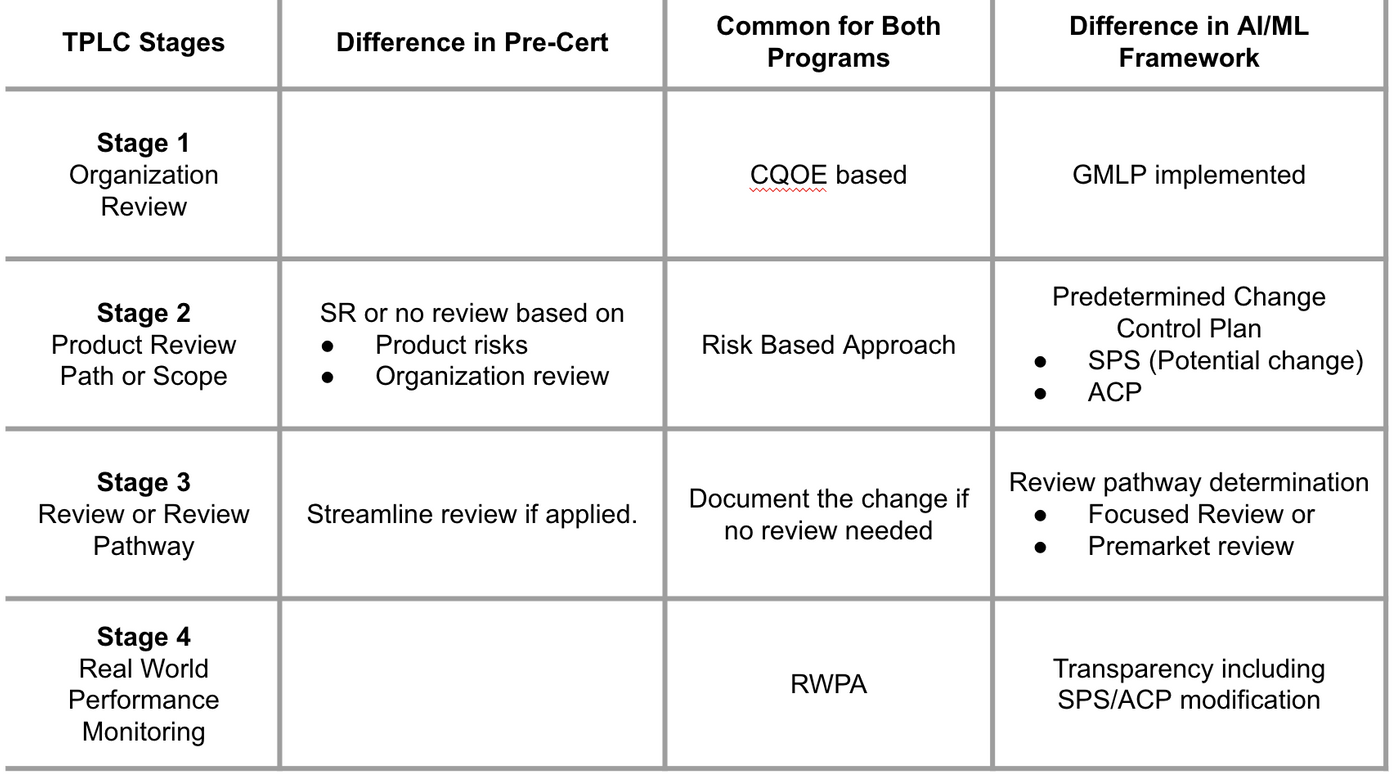
但相同處可發現(1)CQOE要求的組織卓越性(2)真實世界性能表現分析都是基本要求。比較表可參照Table 1.
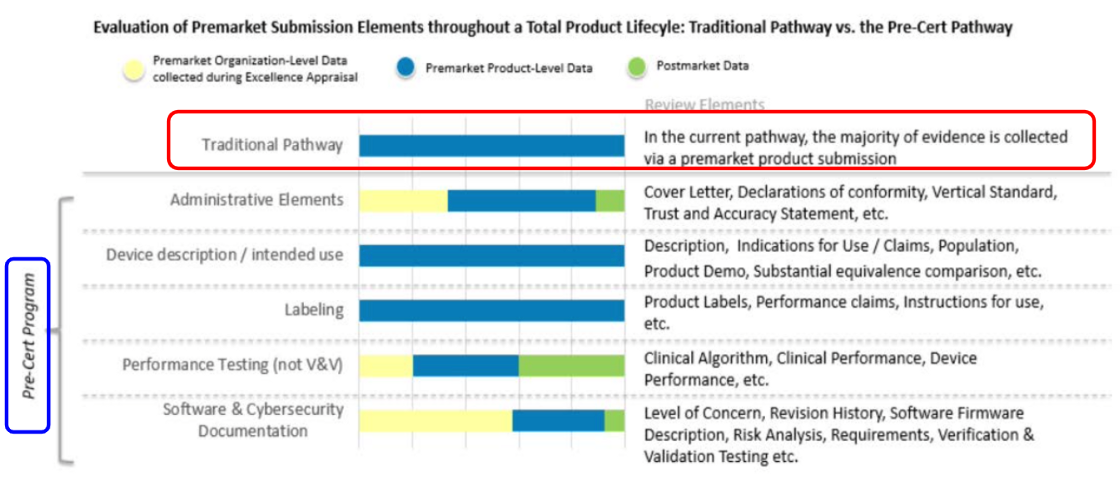
與現有審查的比較(Fig 5,與Pre-Cert Program比較為例),簡言之,傳統審查只關聯到產品面,上市前,而AI/ML與Pre-Cert Program的審核關管理,因為採用TPLC,所以橫跨了Premarket(上市前)及Postmarket(上市後),產品面及組織面。
討論
以後審查法規會走向更全面性,涵蓋更廣,FDA的要求甚至與MDR或IVDR的要求的一致性越來越高。
個人認為這也是開發公司順勢升級的一個最好的機會。
此外,就下一世代的SaMD,AI/ML的使用幾乎無可避免,所以一家公司可能會有這2種SaMD並存,故以下討論可能的調和手法。
從基本的CQOE,RWPA的要求開始建立共同文件,就審核路徑根據不同產品有其對應的二階文件。建議開發流程的調和架構如Fig 6.
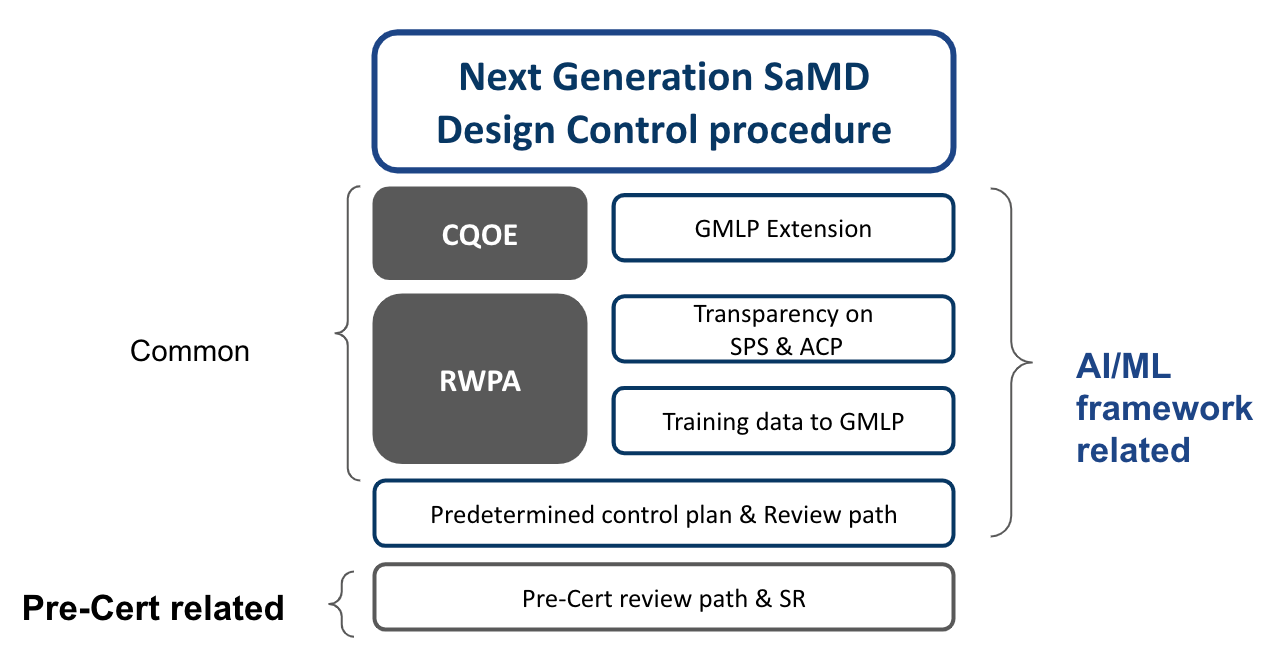
灰底白字部分為Pre-Cert Program與AI/ML Framework共同的架構,其他只與Pre-Cert Program或是AI/ML Framework有關者分別標註,這些對應的部分可獨立出一個二階開發程序。
以下為初步看法
1.二階文件建議:理論上,就軟體品質系統而言,可用同樣的二階開發程序包含這兩種不同的產品,但個人不建議採用,主要是這類產品變化頻繁,可能牽涉到改變也不小,尤其是AI/ML者。建議專責程序書在管理上容易許多。
2.產品管理: 鑑於TPLC的觀念導入,也是以產品生命週期為主,所以一定要用產品管理的方式待之,而非用專案管理(PJM)者。
3.RWPA真實世界的功能表現分析:其中架構的UXA: PMS,PMCF,可與未來結合客服搜集資訊,反饋回去設計端。這個例子也說明了如何建立架構同時符合MDR, IVDR的要求。
就實務面運作的探討,將在另一篇幅討論。
喜欢我的作品吗?别忘了给予支持与赞赏,让我知道在创作的路上有你陪伴,一起延续这份热忱!

- 来自作者
- 相关推荐