關於新冠病毒 SARS-CoV-2
本文已先在 Medium、方格子兩平台發佈,並以方格子原文網址註冊 ISCN。
來談談肆虐了快三年的這個病毒吧!
因為都是最新的研究,難免會有一些比較專業的內容,我盡量避免太細節的東西,來做一些目前已知的資訊的初步介紹,不過還是建議有點高中生物基礎再閱讀本文。
名詞釐清一下,這病毒原本暫被稱為「2019新型冠狀病毒 (2019nCoV)」,在確認為 SARS 的亞種後被正式命名為「SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2)」,中文翻譯是「嚴重急性呼吸道症候群冠狀病毒 2 型」,不過還是被俗稱「新冠病毒」。
而它所導致的疾病稱為「COVID-19 (coronavirus disease 2019)」,中文是「2019冠狀病毒病」,因在中國武漢首次爆發而俗稱「武漢肺炎」。
本文要來介紹的是,我們目前對於這病毒本身掌握到的一些資訊。
SARS-CoV-2 辨識 ACE2
先來看看 SARS-CoV-2 的結構:
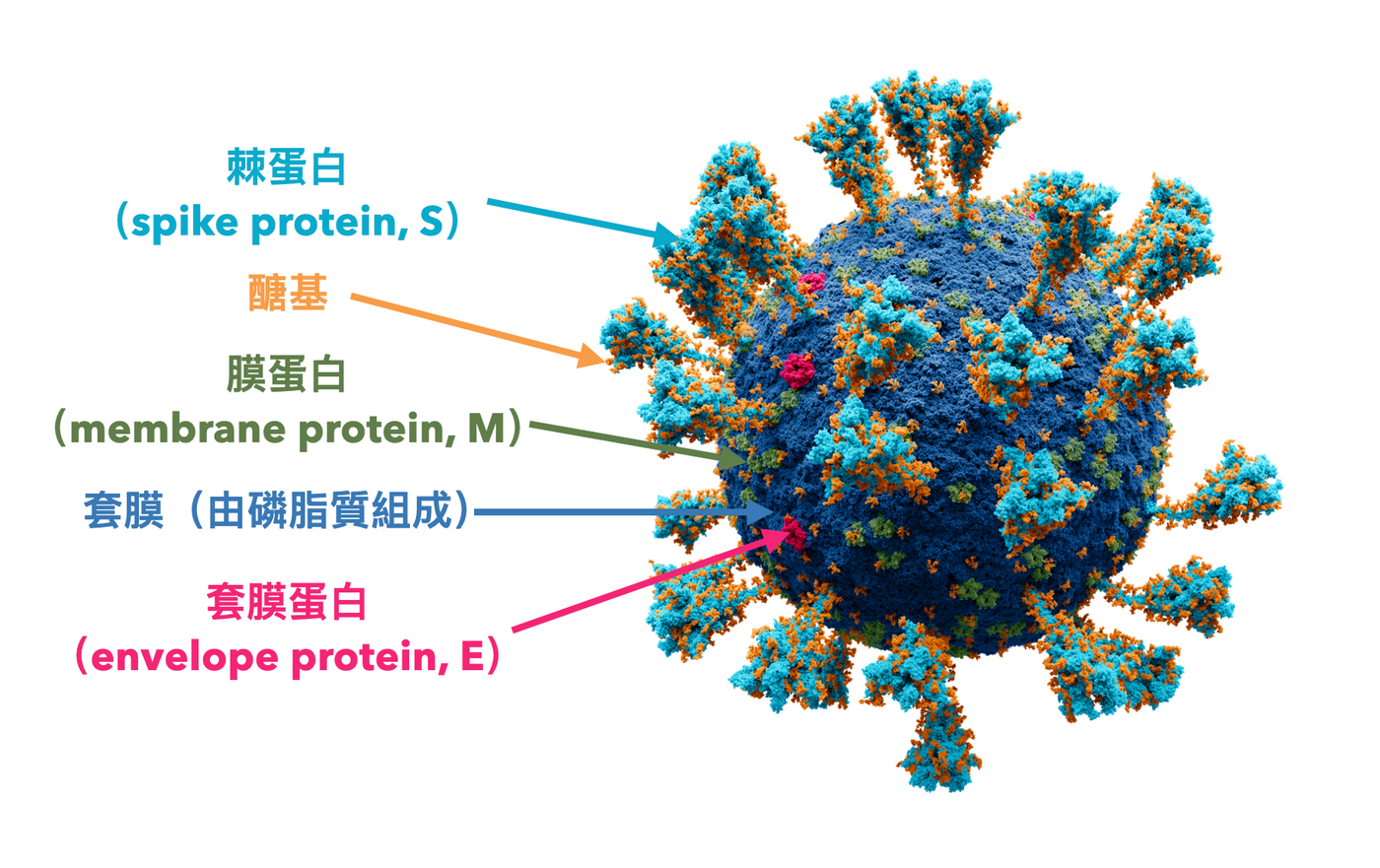
這是冠狀病毒很典型的結構,冠狀病毒 (coronavirus) 是含有套膜的 RNA 病毒,既然和流感病毒一樣有磷脂質構成的套膜,界面活性劑就能輕鬆把它殺死,所以勤洗手的確是很有效的防範方式。
可是為何他有那麼強大的傳染力?這才是大家感興趣的問題。這裡我要先聚焦在棘蛋白 (spike protein, 以下簡稱 S) 上,因為它是病毒侵入我們體內細胞的關鍵。
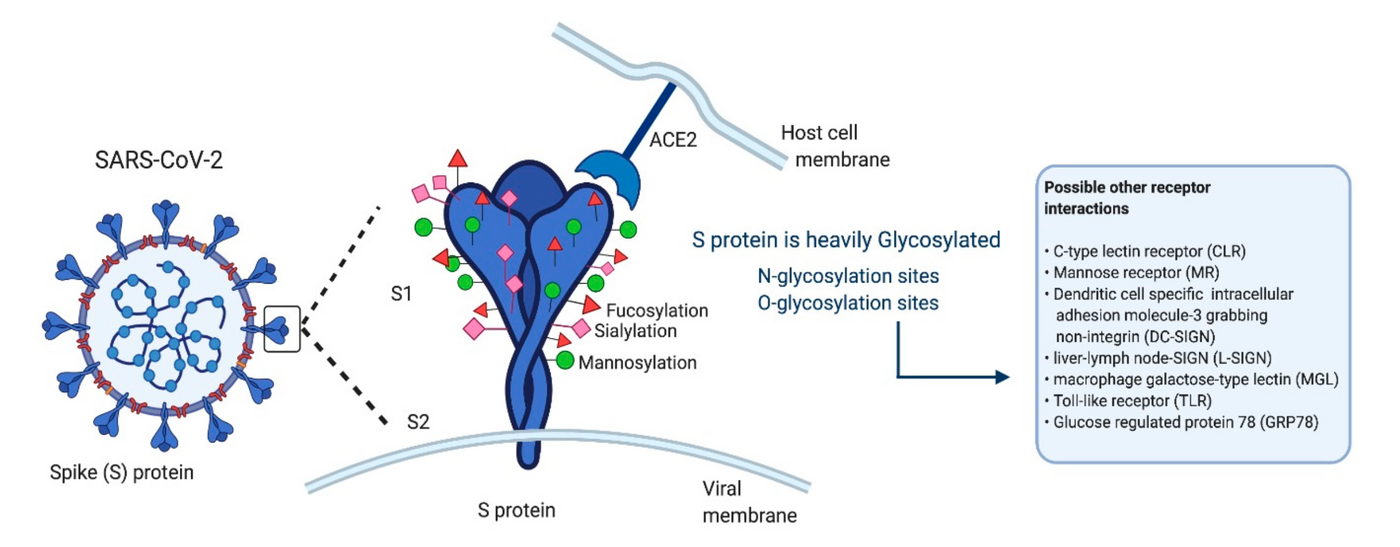
上圖是 S 辨識細胞表面受體蛋白 ACE2 (angiotensin-converting enzyme 2) 的示意圖,雖然其實不只有 ACE2,還有其他辨識的目標(上圖的右邊列出了一些可能的其他受體),但目前認為還是以 ACE2 為主。
什麼是 ACE2?中文是「血管收縮素轉化酶 2」。血管收縮素 (angiotensin) 想必有讀選修生物的高中生都不陌生,它是 RAAS 系統 (renin-angiotensin-aldosterone system) 裡上促進醛固酮 (aldosterone) 分泌的前驅物,不知道我在說什麼的話,簡單來說是血液中會導致血壓上升的其中一種物質。
然而血管收縮素在血液中原本是沒有被活化的,經過一個稱為 ACE 的酶的轉化之後才有活性。而這裡的 ACE2 和 ACE 是彼此拮抗的關係,ACE2 是會把血管收縮素轉化成沒有活性的狀態的酶,抑制血壓上升,且 ACE2 是許多人體組織細胞膜上的跨膜蛋白,也分佈在肺泡上皮。
原本作為膜上的酵素的 ACE2,正好成為了 SARS-CoV-2 的 S 蛋白辨識的主要目標,一旦 S 辨識到 ACE2 之後就會啟動後續將病毒套膜和細胞膜結合的機制,也因此有許多其他研究在探討 SARS-CoV-2 和高血壓的關係,畢竟有蠻多案例顯示高血壓患者的重症比例好像較高,不過目前詳細機制還不太明朗。
而辨識 ACE2 倒也不是很特別的一件事,因為 2003 年的 SARS-CoV 也是辨識 ACE2,只是研究發現 SARS-CoV-2 和 ACE2 的結合力更強,可見它的特別之處應該在於它的 S。
SARS-CoV-2 的 S 蛋白
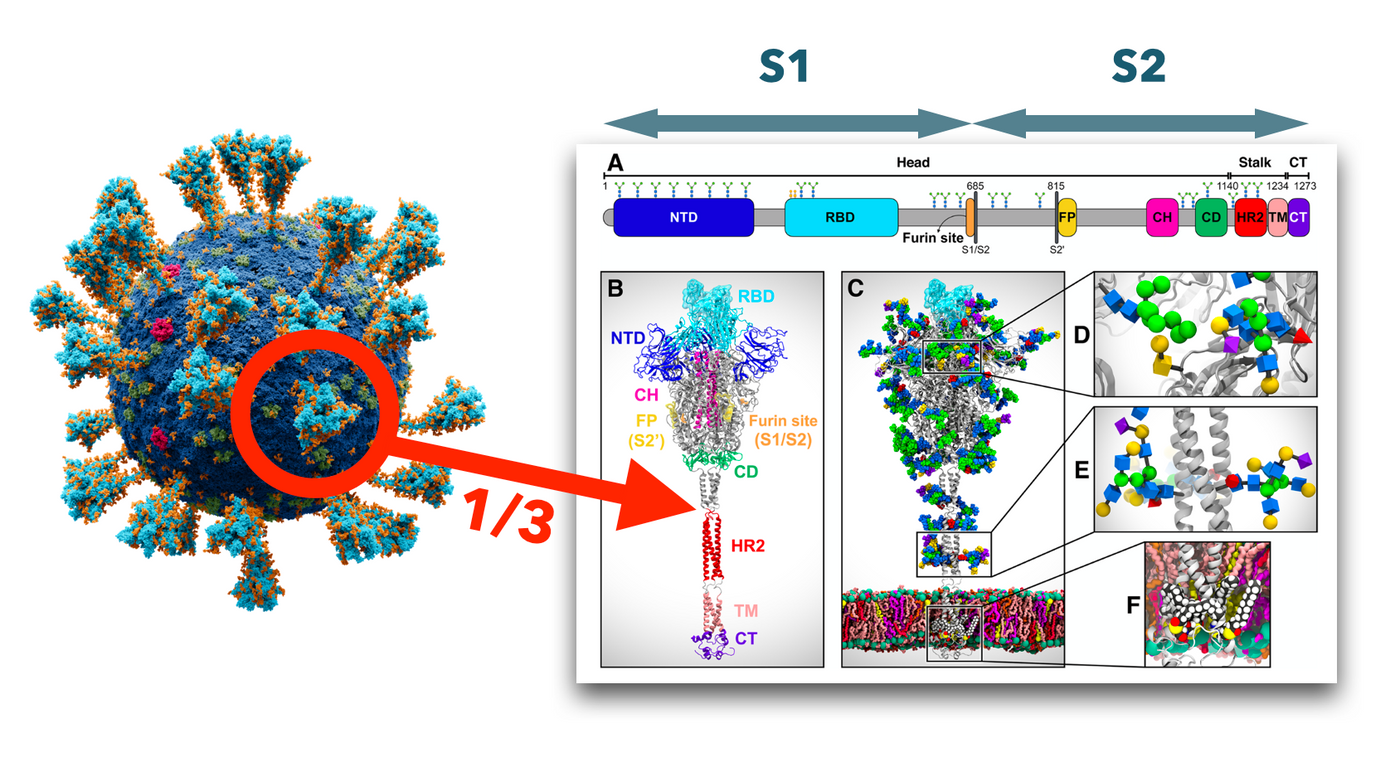
來介紹一下 S 的結構。每個 S 其實是個三聚體,由三個相同的單體組成,上圖右邊就是那單體的結構,上方的橫列是它的胺基酸序列。而每個單體分成兩大塊區域:上方的頭部 S1 和下方的桿狀 S2 (其實更像是鐵鍊一樣分成幾節,讓上方的 S1 可以到處晃動)。其中 S1 的 RBD (receptor-binding domain) 是結合 ACE2 的位點。這些胺基酸被轉譯出來後會經過修飾,在上面裝上一堆醣基,也就是左邊那圖上橘色的小點。這些醣基作用非常重要喔,因為它們可以協助病毒逃過你的免疫系統。
但這其實不是 SARS-CoV-2 特有的,用醣類來當防護罩這招可是各種病原體都常用的伎倆,細菌的莢膜不也是嗎?在病毒這裡是為了覆蓋 S 上的「抗原決定位 (epitope)」,也就是免疫系統(抗體)要去辨識的地方。SARS-CoV-2 的抗原決定位分佈在 S 的各處,且主要在 S2 的部分,但也不只在 S 上有抗原決定位,病毒表面的膜蛋白也有 (D. Camerini et al., 2021)。
而很多 paper 拿 2003 年的 SARS、2012 年中東的 MERS 和現在的 SARS-CoV-2 的基因序列來比對,這三個都屬於乙型冠狀病毒屬,發現他們的 S 的序列高度保守,也就是基因序列大致相同,尤其是 S2 的部分極其相似 (M. M. Hatmal et al., 2020)。請先記得這件事,最後面會告訴你這有什麼好處。
主要差異在 S1 的部分,像是 RBD。RBD 序列有些微的不同都會導致結構上有所不同,分子結構的差異就會影響它和 ACE2 的結合力,也當然就影響了在你體內複製的能力,以及傳染力。這也有非常多研究在探討 RBD 和 ACE2 結合時的結構,甚至有人建模去估算 SARS-CoV-2 的結合結構中的靜電力有更高電力線密度,說明結合力的差異 (Y. Xie et al., 2020)。
SARS-CoV-2 的變種
前面介紹到了冠狀病毒間 S 的不同,而 SARS-CoV-2 自己的突變也會導致 S 的不同,這就是你常聽到的「變種 (variant)」,或稱「變異株」。
現在全世界已經有數千種不同 SARS-CoV-2 的變種,畢竟上億個感染者就代表著極大的病毒生長環境以及更大的突變發生數量,每有新的病毒被複製出來,基因都有一定的機率發生複製錯誤,而產生突變。
變種的基因序列差異導致轉譯出的 S 的差異(尤其是 S1,因為 S2 高度保守),因此改變了新變種的傳染力。抗原決定位當然也會有所改變,所以你就算感染過 A 變種,下次感染到 B 變種時你的免疫系統可能得重新認識它,你就再次發病。
這個現象稱為「抗原漂變 (antigenic drift)」,流感病毒會有各種不同變種也是一樣的道理,像是 A 型流感的 H1N1、H3N2 等,就是因為流感病毒表面的血球凝集素 H (hemagglutinin) 和神經胺酸酶 N (neuraminidase) 的突變,導致病毒的感染力和抗原決定位改變,因此流感總是一直來,疫苗也要一直打。
關於變種的命名方式有好幾種,我們一般最常聽到的命名方式是 Pango 的命名系統,這命名方法把 2019 年底和 2020 年初辨識出來的兩條分支命名為 A 和 B,其後的子系就加一個點,開始按照數字排。
例如 B 的第一個子系就是 B.1,下一個是 B.2,如果是 B.1 的子系的話就是 B.1.1,用這樣的方式來表達變種間的關係。但為了避免一直無限點下去,所以規定數字最多三位,如果要再往下分支的話就跳一個新字母,例如 B.1.1.1.1 要改名叫 C.1。
其中如果有變種的傳染力或致死率較高而造成顯著影響的話,就會被我們特別關照,以下是美國 CDC(相當於我們的疾管署)和 WHO(世界衛生組織)對它們分的等級(中文翻譯各異,請以英文為準):
【美國 CDC (Centers for Disease Control and Prevention)】
- 被監視變異株 (Variants Being Monitored, VBM)
- 需留意變異株 (Variants of Interest, VOI)
- 高關注變異株 (Variants of Concern, VOC)
- 嚴重後果變異株 (Variants of High Consequence, VOHC)
【WHO (World Health Organization)】
- 監視中變異株 (Variants under Monitoring, VUM)
- 需留意變異株 (Variants of Interest, VOI)
- 高關注變異株 (Variants of Concern, VOC)
隨著疫情的變動也會改變病毒所屬等級,而曾經爬到 VOI 以上的病毒就會給予特定希臘字母名稱方便稱呼,像是 B.1.525 被稱為 Eta、P.2 被稱為 Zeta。至於曾經達到 VOC 的變種就是被我們高度關注的 Alpha (B.1.1.7)、Beta (B.1.351)、Gamma (P.1)、Delta (B.1.617.2)、Omicron (B.1.1.529),目前只剩 Omicron 還是 VOC,其他都已經下去了。
而現在著名的 BA 字首的變種(例如 BA.5),全都是 Omicron 的子系。當字母不夠用了,Pango 會視情況公布往下開的新字首是什麼。至於 CDC 定的 VOHC 等級,目前還沒有病毒到那程度過。
關於這強大的 Omicron 變種的介紹,可以參考這篇中研院的文章:
https://sarscov2.sinica.edu.tw/doc/20220128.html
SARS-CoV-2 的特別之處?
前面只談了 SARS-CoV-2 的 S 的變異,S 結構的不同的確是造成 SARS-CoV-2 有那麼恐怖的傳染力的原因之一,但這樣可不足以讓人信服,流感病毒也有許多種變種,憑什麼 SARS-CoV-2 可以造成全球大流行?
這三年來全球的生物學家們陸陸續續發現了各種 SARS-CoV-2 的神奇現象,以下和讀者介紹其中幾個。
我們先來看一下 SARS-CoV-2 的生命週期:
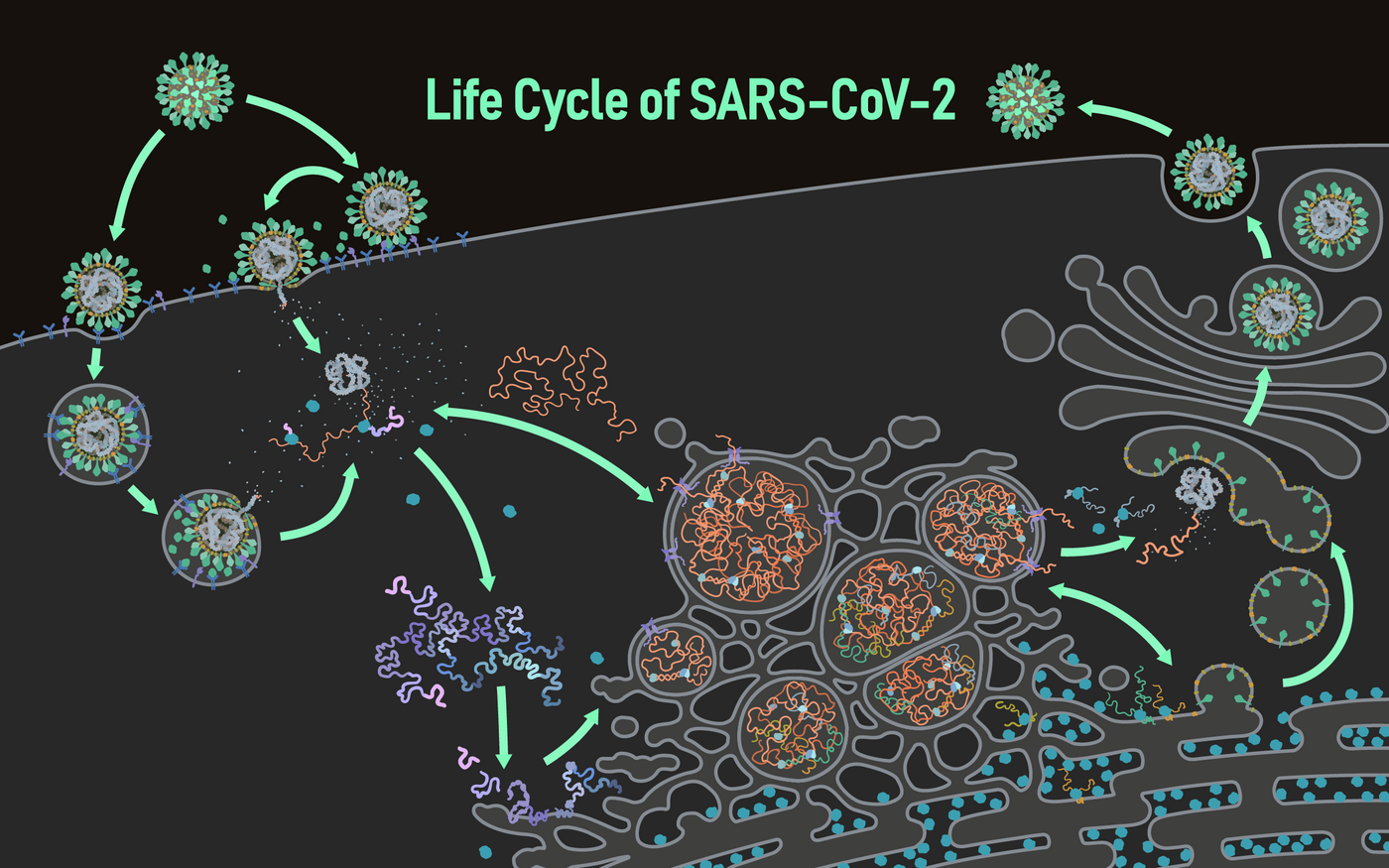
在 S 辨識了 ACE2 之後,病毒把自己的遺傳物質 RNA 丟進去宿主細胞。進去後發生的事可多了,像是 SARS-CoV-2 在感染細胞後,會立刻利用宿主細胞轉譯出一些蛋白,去阻斷宿主細胞核的核孔,讓宿主的 mRNA 無法離開核,進而無法產生宿主想製造的蛋白,例如干擾素(受感染細胞通知免疫系統的一種蛋白),因此有效地阻止細胞去觸發免疫反應。雖然這在其他冠狀病毒也有,但 SARS-CoV-2 的影響更顯著 (K. Zhang et al., 2021)。
為什麼?這也是現在病毒學家們很疑惑的問題,目前發現了很多很有趣的現象,但我們對細胞內發生的事了解相當少,細胞內的事也更難去研究,基本上還是滿滿的問號。
再注意到圖片下半部,可以看到它在內質網會折出很多雙層膜的環境,這在其他冠狀病毒上也會看到,這樣的雙層結構稱為 DMV (double-membrane vesicle),病毒 RNA 可以在裡面瘋狂複製而不被外界的宿主細胞其他物質干擾。離開 DMV 之後,會在內質網和高基氏體之間的 ERGIC (ER-Golgi intermediate compartment) 組裝,並前往高基氏體進行醣基化等轉譯後修飾,然後如同細胞平常向外分泌蛋白一樣離開細胞。
其他也含有套膜的病毒,像是登革熱病毒、C 型肝炎病毒,也是透過類似的方式,經由高基氏體離開細胞。但研究發現就算阻斷這條路徑,SARS-CoV-2 等乙型冠狀病毒屬還是有辦法離開細胞,而且居然是利用溶體(負責分解細胞內老廢物質的胞器),其中的蛋白酶也處於沒有活化的狀態 (S. Ghosh et al., 2020)。
更神奇的是,SARS-CoV-2 甚至還會調整細胞的膜的構造,讓細胞和鄰近也有 ACE2 的細胞的膜結合,形成一坨更大型的「合胞體 (syncytia)」,就像你的肌肉細胞一樣彼此連通,逐步改造出一個複製病毒的超大樂園 (L. Braga et al., 2021)。這個現象在其他冠狀病毒上可沒有,連它的近親 2003 年的 SARS 也沒有,倒是在愛滋病毒 HIV 還有最近開始爆發的「呼吸道融合病毒 (respiratory syncytial virus, RSV)」上會看到。
還沒完,甚至有研究發現連淋巴球都有被拿來蓋這個複製樂園 (Z. Zhang et al., 2021),如此蔑視免疫系統的囂張行徑可不是一般病毒能做到的事,而是在癌症,也就是腫瘤細胞上會看到,例如所謂的「腫瘤相關巨噬細胞 (tumor-associated macrophage, TAM)」,它不但無法消滅腫瘤,還助長腫瘤增生。看到這裡,是不是覺得有點恐怖 XD。
更加詳細的機制多半還是謎團,但了解這些資訊有什麼實質用途嗎?比方說前面提到的在內質網形成的 DMV,如果能夠讓疫苗或相關藥物抑制它的形成,就能有效阻止病毒複製 (L. Braga et al., 2021)。
當我們了解的越多,就越有機會找到更多不同的應付手段。
延伸:對所有變種都有效的疫苗?
不知道是否還記得一開始說的 SARS-CoV-2 變種的 S2 有高度的保守性,如果能夠讓疫苗著重在使免疫系統加強辨識這裡的抗原決定位,是不是有機會做出對抗所有變種的疫苗呢?
這其實正是今年初我國中研院發表的研究內容 (C.-Y. Wu et al., 2022)。
疫苗是透過注射沒有致病力的病毒的一部份 (如 mRNA、次蛋白),讓你的免疫系統去記住病毒的特徵。近年興起的 mRNA 疫苗(如 BNT 和 莫德納)就是利用注射能夠轉譯出 SARS-CoV-2 的 S 蛋白的 mRNA,讓你的細胞產生病毒的 S,供免疫系統辨識,等真正遇到病毒後就能更有效率的應對,減輕你的免疫反應,也降低重症可能性。
既然 S2 在不同變種間幾乎一致,S2 上又有許多抗原決定位,只是被許多醣基給覆蓋,如果讓 mRNA 疫苗製造出的 S 的上醣基消失的話,豈不是能大幅降低免疫逃脫的可能,甚至對所有變種都有效呢?
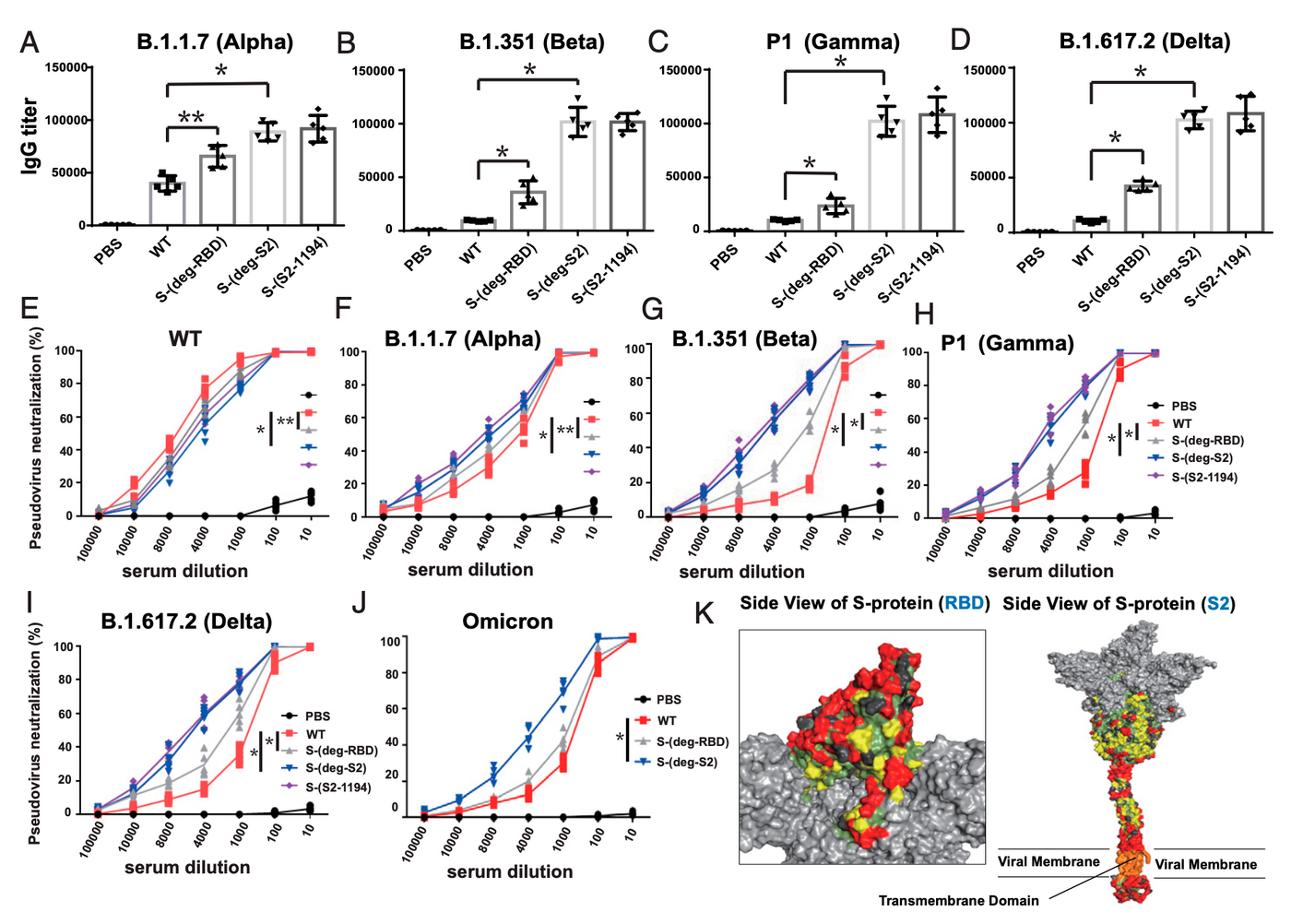
中研院這篇研究就是為了加強免疫系統對 S 的抗原決定位的辨識,修改 mRNA 上的序列,造成醣基結合在 S 上的位點的胺基酸序列改變,轉譯後修飾時則無法接上醣基,也就無法遮蓋抗原決定位。實驗數據結果也顯示這讓疫苗對 Alpha、Beta、Gamma、Delta、Omicron 變種的保護力都有顯著提升,可望製造出對所有變種都有效的疫苗!
參考資料
- L. K. Gadanec et al., Can SARS-CoV-2 Virus Use Multiple Receptors to Enter Host Cells? Int. J. Mol. Sci. 22, 992 (2021).
- L. Casalino et al., Beyond Shielding: The Roles of Glycans in the SARS-CoV-2 Spike Protein. ACS Cent. Sci. 6, 1722–1734 (2020).
- D. Camerini et al., Mapping SARS-CoV-2 Antibody Epitopes in COVID-19 Patients with a Multi-Coronavirus Protein Microarray. Microbiol. Spectr. 9, e01416–21 (2021).
- M. M. Hatmal et al., Comprehensive Structural and Molecular Comparison of Spike Proteins of SARS-CoV-2, SARS-CoV and MERS-CoV, and Their Interactions with ACE2. Cells 9, 2638 (2020).
- Y. Xie et al., Spike Proteins of SARS-CoV and SARS-CoV-2 Utilize Different Mechanisms to Bind With Human ACE2. Front. Mol. Biosci. 7, 591873 (2020).
- K. Zhang et al., Nsp1 Protein of SARS-CoV-2 Disrupts the mRNA Export Machinery to Inhibit Host Gene Expression. Sci. Adv. 7, eabe7386 (2021).
- S. Ghosh et al., β-Coronaviruses Use Lysosomes for Egress Instead of the Biosynthetic Secretory Pathway. Cells183, 1520–1535 (2020).
- L. Braga et al., Drugs that Inhibit TMEM16 Proteins Block SARS-CoV-2 Spike-induced Syncytia. Nature 594, 88–93 (2021).
- Z. Zhang et al., SARS-CoV-2 Spike Protein Dictates Syncytium-mediated Lymphocyte Elimination. Cell Death Differ. 28, 2765–2777 (2021).
- C.-Y. Wu et al., Glycosite-deleted mRNA of SARS-CoV-2 spike protein as a broad-spectrum vaccine. Proc. Natl. Acad. Sci. U.S.A. 119, e2119995119 (2022).
- 如果喜歡我的文章,還請不吝【👏拍手】、【➕追蹤】!
- 我平常更常在 instagram 發布短文,等內容累積到一定的量後才會整理出完整文章發布在這,也歡迎有興趣的讀者來逛:@study.msh
喜欢我的作品吗?别忘了给予支持与赞赏,让我知道在创作的路上有你陪伴,一起延续这份热忱!
