數位療法佈局探討(2)-四大面向
根據IQVIA 2021數位健康趨勢報告,其趨勢分析看4大面向,創新(Innovation), 實證(Evidence), 法規(Regulation), 以及採用(Adoption)
個人以該報告提出4大面向為主軸,整合該報告與個人觀點闡述之
(1) 加速中之數位健康工具創新
根據IQVIA 該報告,在2021前,超過35萬個與健康有關的App推出,光是在2020年,推出了超過9萬個健康有關的App。
穿戴式(wearable)產品也是加速這類App導入的動力。
但就個人看法,因為validating以及實證(evidence-based)的要求, 穿戴式(wearable)產品要進入DTx,或是DC的領域,還有一段很長的路要走。
反而是一些現有的醫材與這類App的結合的產品,進入DTx,DC的場域還是會比wearable來的早。
原因在於法規門檻與應用門檻。
法規門檻
由於醫療產業與人命有關,所以在新技術的導入則是相對保守許多,不是技術達標即可,而是要經過種種安全性,性能驗證後,才有上市的機會。
上市其實只是一個安全性與性能上的低標,拿到許可只能代表可用沒問題,但性能到什麼程度,則是個未知。
此外,因為很多衛生機關是採取相信廠商的原則,只要廠商的實驗程序正確,數據看來合理,很少會刁難。
但有些國家的衛生主管機關也不是傻瓜,知道一定會有害群之馬,所以會定期請第三方驗證單位,購買市面上的產品,抽樣測試,不定期公開。這些測試報告,對一些通過的廠商會是一項有利的證據。
另外,也有同業會購買其他競爭對手的產品,送交第三方驗證單位測試,最有名的例子是血糖機某世界第一大品牌的公司,定期收集歐洲區域販售的血糖機產品。
結果在某一年,其評鑑結果第一名居然是台灣某公司,而該大廠與些微差距為第2名,這家公司也很有風度公布評鑑,而那家台灣公司從此在該產業一炮而紅。
所以,上市其實只是一個安全性與性能上的低標,至少經過種種的第三方驗證,有了一些可行的第三方驗證,只代表產品是貨真價實的。
應用門檻
如果還要證明在照顧/治療疾病有幫助,那還要Application Study。需要整合醫材與指定適應症進行臨床實驗,證明採用該產品能有效改善相關適應症。
如果要到可以被保險公司,甚至政府採用,實驗數量及品質,也是關鍵因素。
(2) 推進中之監管審批與商業化
最近支付英國的NICE導入失眠治療APP,以及日本核准高血壓數位療法APP,加上美國FDA推展Pre-cert program以因應不斷變化的數位醫療產品,以及AI/ML Framework類的審批法規。
Fig 2為IQVIA 該報告中指出目前通過監管審批的數位療法(DTx)的區域分佈,其中歐盟的CE佔76.9%,美國FDA34.6%次之。同時取得CE,FDA核可者約15.3%,
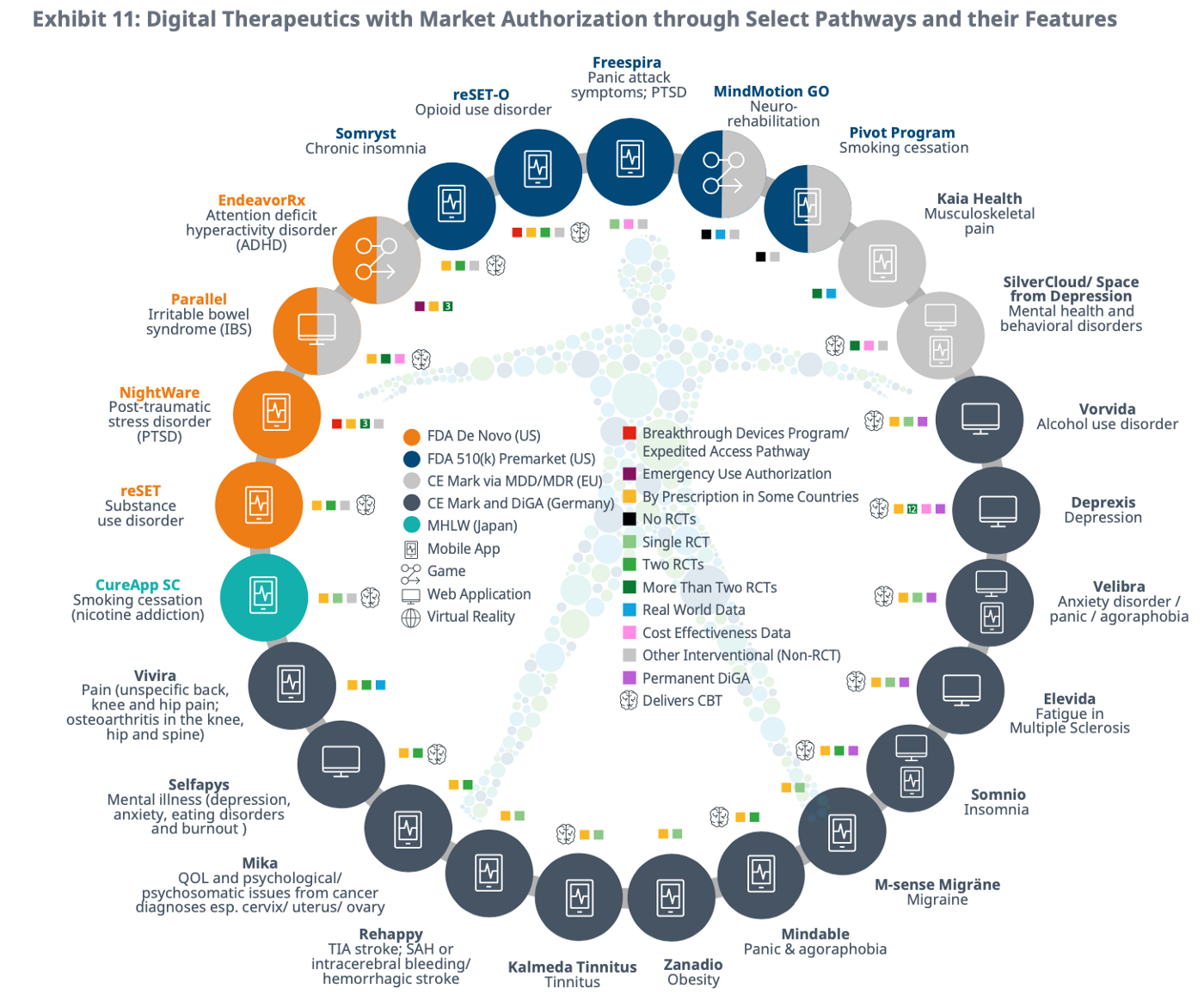
值得一提的,這些應用以神經醫學,身心醫學為主,其中在數位療法DTx約佔2/3, 在數位照護DC則約40%, 其中有些數位照護DC在內分泌,癌症,心血管疾病等照護也會採用認知行為療法(cognitive behavioral therapy ,CBT)為其療法的一部分。[註1]
其實早期先進醫材無法上市的最大障礙就是監管單位沒有配套的法規,經過這10年來廠商與監管單位的互動,已有顯著的進展。
(3) 臨床證據日益成熟
就臨床證據的產生有幾個級別,觀察性試驗(Observational study),隨機對照試驗 (randomized controlled trial, RCT),系統性文獻回顧是(Systematic Review),以及統合分析 (Meta-analysis):
觀察性試驗(Observational study):用來測量某種介入在非實驗性的「實際狀況」下的療效。觀察性研究無法作為醫療行為「安全性、有效性或是效果」(safety, efficacy, or effectiveness)的可靠來源,不過仍然可以提供一些相關的資訊:
「這些研究可以:1) 提供實際上使用及實行醫療行為的相關資訊 2) 檢測在一般族群中使用特定醫療行為的好處及風險 3) 有助於建立假說,在後續的實驗中確認 4) 提供社羣層級的資料,可以用設計更多信息性的實用臨床試驗 5) 提供臨床實務的相關資訊。[註2]
隨機對照試驗 (Randomized Controlled Trial, RCT):是目前用來測試新型藥物或療法的黃金標準,針對上市前新產品的效力與安全性進行測試。「隨機」(randomized),即研究人員隨機分配受試者至實驗組(接受待測療法)或對照組(未接受待測療法);對照(controlled),即相對於接受治療的實驗組,使另一群人接受安慰劑或虛假的治療作為參考。透過「隨機分配」與「對照組」的存在,可減少實驗偏差、確保其測試結果的可靠性和有效性。[註3]
系統性文獻回顧(Systematic Review):是針對問題內的既有文獻進行的評價,使用嚴謹、可複性高且造成最低誤差的方法,有系統地搜索、分辨、選擇、評價和綜合與研究主題有關的資料。系統性文獻回顧被認為是最好的研究文獻來源,對以實際證據為準的醫學來說是關鍵性的存在,此方法在其他領域也相當被推薦.[註4]
統合分析 (Meta-analysis):是一種運用統計技術,綜合先前獨立執行研究之結果的一種評述程序。整合分析為了統整發現,先大量蒐集個別研究的分析結果,再作統計分析,以尋求一般性結論的技術;具有對研究因果關係、敘述的討論,提出替代性處理,以便能擴充研究文獻的意義。[註5]
就證據力來看,統合分析>系統性文獻回顧>隨機對照試驗>觀察性試驗.
隨機對照試驗與觀察性試驗為單一的試驗,可以算是點的描述,而統合分析與系統性文獻回顧則是探討整個群體的現象,因為證據愈多,所以可信度越高。
所以在Fig 2就從2007到2020所發表的數位健康效能研究數量之探討,其中成熟度的指標為採用合分析與系統性文獻回顧佔所有研究的比例。
就圖表觀之,成熟度是每年逐漸成長,到2020以達14%。
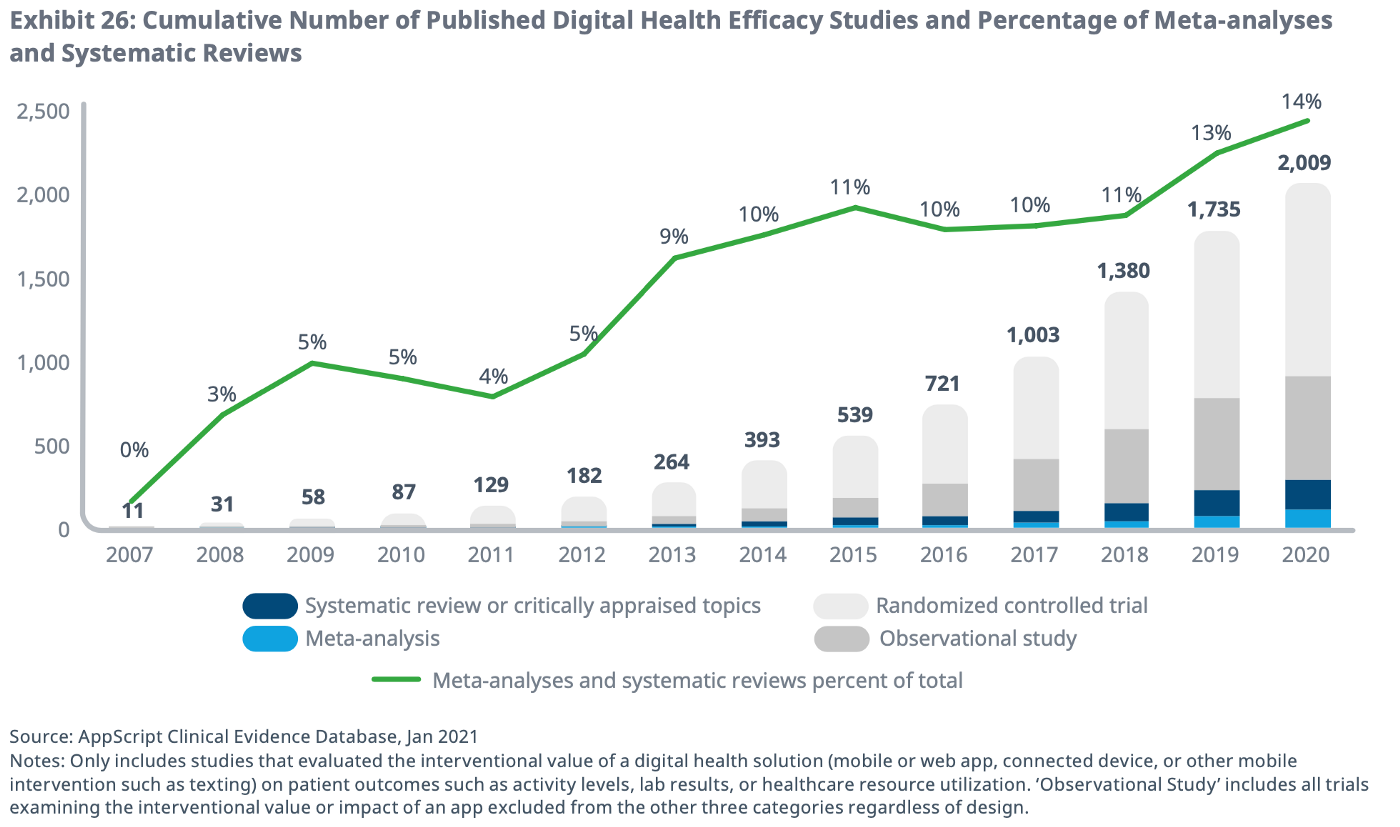
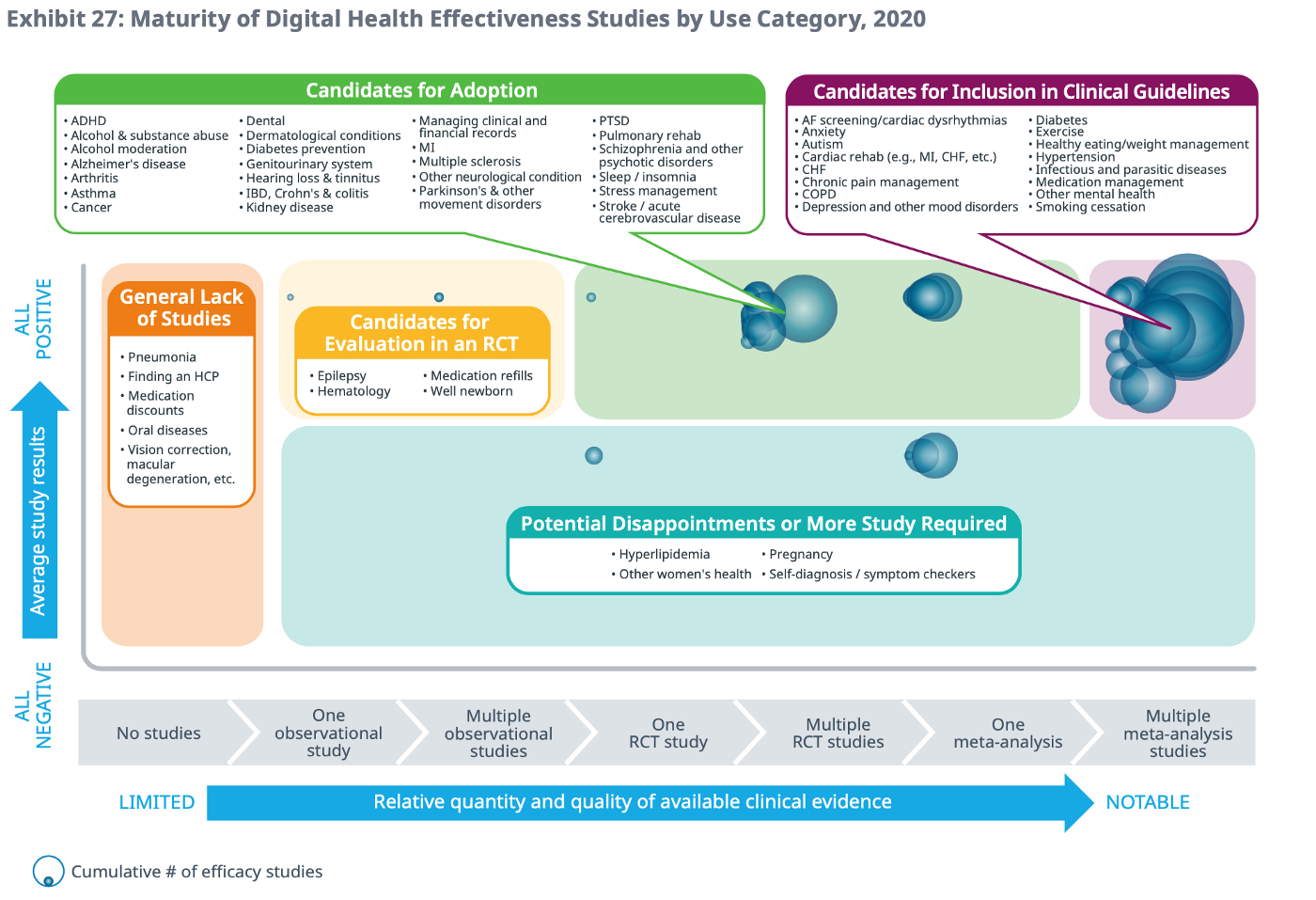
Fig 3就整個成熟度,做更微觀的分析,橫坐標為證據的成熟度,縱座標為結果的正向程度,在本圖展現各類適應症的證據程度。
(4) 克服採用障礙
通過監管機關的核准,以及臨床上也有足夠的證據下,下一個最大挑戰就是市場的採用。
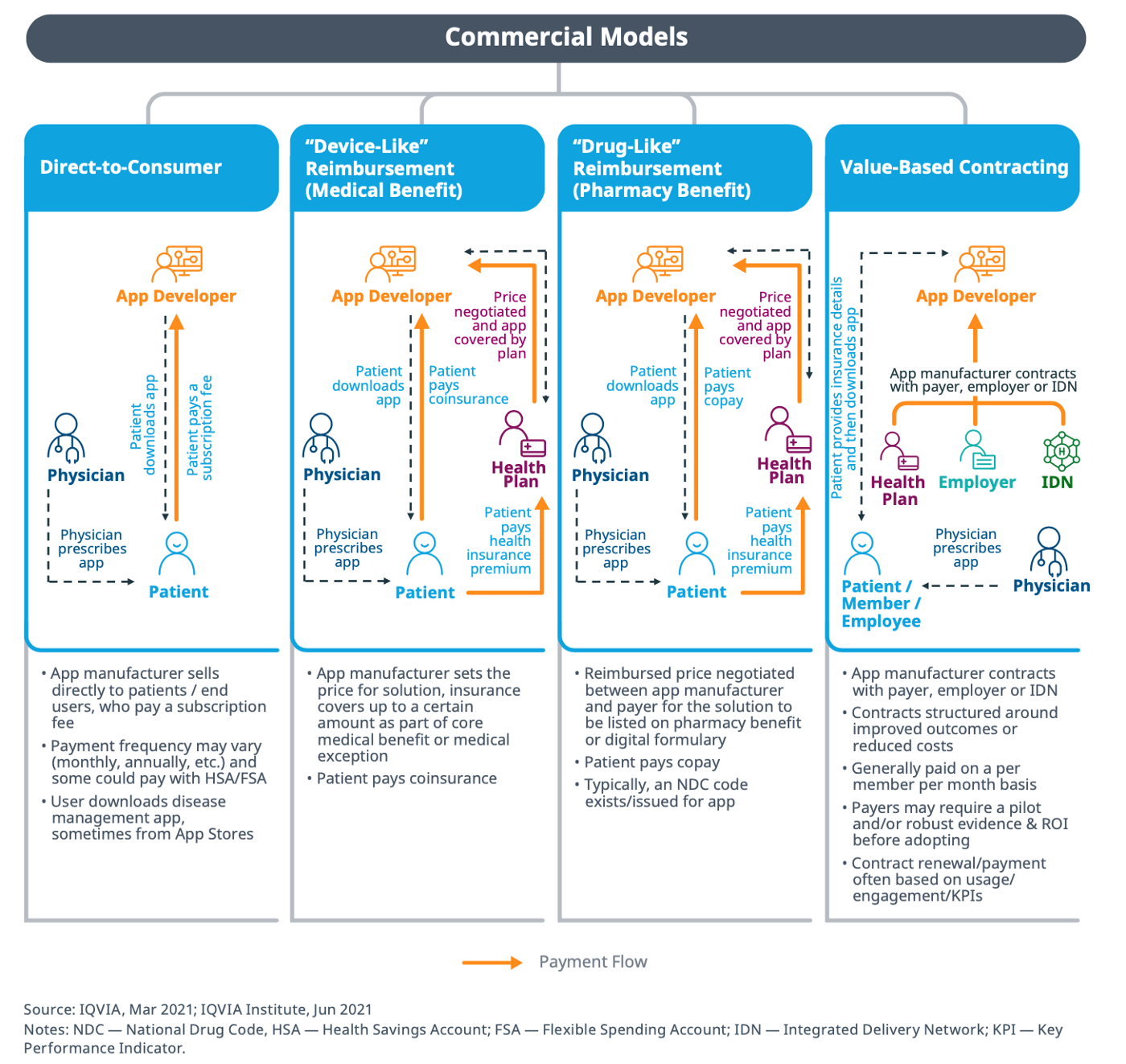
就Fig 4觀之,這類產品的商業模型主要有4大類
(1) 直接對應消費者(Direct-to-Consumer):如同一般App,上架後直接面對客戶,由使用者直接付費,或是由健康照護提供者提供相關資訊,如QR code, 推薦病人自費使用。
(2) 醫材形式的保險給付(”Device-Like” Reimbursement, (Medical Benefit)): 如同在一些國家,某些醫材是有健保給付,則以該國家的相關政策進行。
(3) 藥品形式的保險給付(”Drug-Like” Reimbursement, (Pharmacy Benefit)): 這部分主要是以美國的環境有關,如果被定位成藥物,則可能與PBM (pharmacy benefit manager)有關,根據美國藥劑師協會的說法,「PBM主要負責的是在處方集的開發和維護,與藥房簽約、與藥廠議定折扣和回扣、以及為處方藥的理賠作處理和支付。」[註6]
也就是給付條件會與PBM有關。
(4) 價值根基的承包(Value-Based Contracting): 這裡舉最合適的例子,在美國,有一種保險公司與醫療的複合機構,稱之IDS(Integrated Delivery Service)或IDN [註7],最經典的是一家叫Kaiser Permanente的機構。
因為保險與醫療都是在同一個系統,所以從保險的角度,會一直追求醫療效果最好,但不浪費保險支出的手法,這種單位重視的是Fee for Performance (以成果計費)。而一般醫療單位則是Fee for Sevice(以服務計費)。
最大的不同是以服務計費會常見濫開手術,以增加收入,這也是很多國家醫療保險快破產的原因。而以成果計費則是以病人的健康狀況為標的。這也是鑑於醫療資源濫用下的解決手法。但只能在這種IDS/IDN類似的機構實行。
舉某家IDN的例子,這家IDN在心血管科因為採取Fee for Performance (以成果計費),所以病人得到有效的照顧,減少了動手術的需要,所以該單位就手術的收入大幅減少,但從機構的保險部門發現,這個單位從保險支出省下的錢,大於之前的手術收入,所以對真個機構的支出是節省的,所以該科的醫生還是有拿到紅利做獎勵。
所以這類可輔助藥物,具有證明療效的手段,可以省掉不必要的藥費,對這類IDS/IDN機構而言,是很有利基的。
這裡值得一提,DC這類的產品,因為落入醫材或是藥物給付的機率不高,故IDS/IDN是最合適的採用場域。
結語
就這十幾年來的發展,已有不少DTx, DC產品取得充足的臨床證據,但市場的採用,是最終也是最困難的挑戰。
就個人觀察,這類產品最可能從第4個商業模型開始發跡,因為這類產品符合IDS/IDN這類的Fee for Performance (以成果計費)的需求。另外,公醫制度也是很適合這類產品的發展。
Fig 5 為目前美國保險公司與IDN所採用的數位處方集。

但因為IDS/IDN還不是醫療產業的主流,所以變成醫材或是藥品類型給付還有一段路要走。
但筆者認為這還是未來必定發生的趨勢。
註1:https://www.iqvia.com/insights/the-iqvia-institute/reports/digital-health-trends-2021
註2:https://zh.m.wikipedia.org/zh-hant/观察性研究
註3:http://www.angle.com.tw/ahlr/discovery/post.aspx?ipost=3402
註4:https://www.editage.com.tw/resources/tutorial/a-young-researchers-guide-to-a-systematic-review.html
註5: https://terms.naer.edu.tw/detail/1314566/
註6: https://zh.wikipedia.org/wiki/藥物福利管理
註7: https://en.wikipedia.org/wiki/Integrated_delivery_system
