潛水活動中的理論

來說說上課的時候聽到的一些很燒腦的定律,雖然很煩躁但是跟潛水安全卻是息息相關的理論。
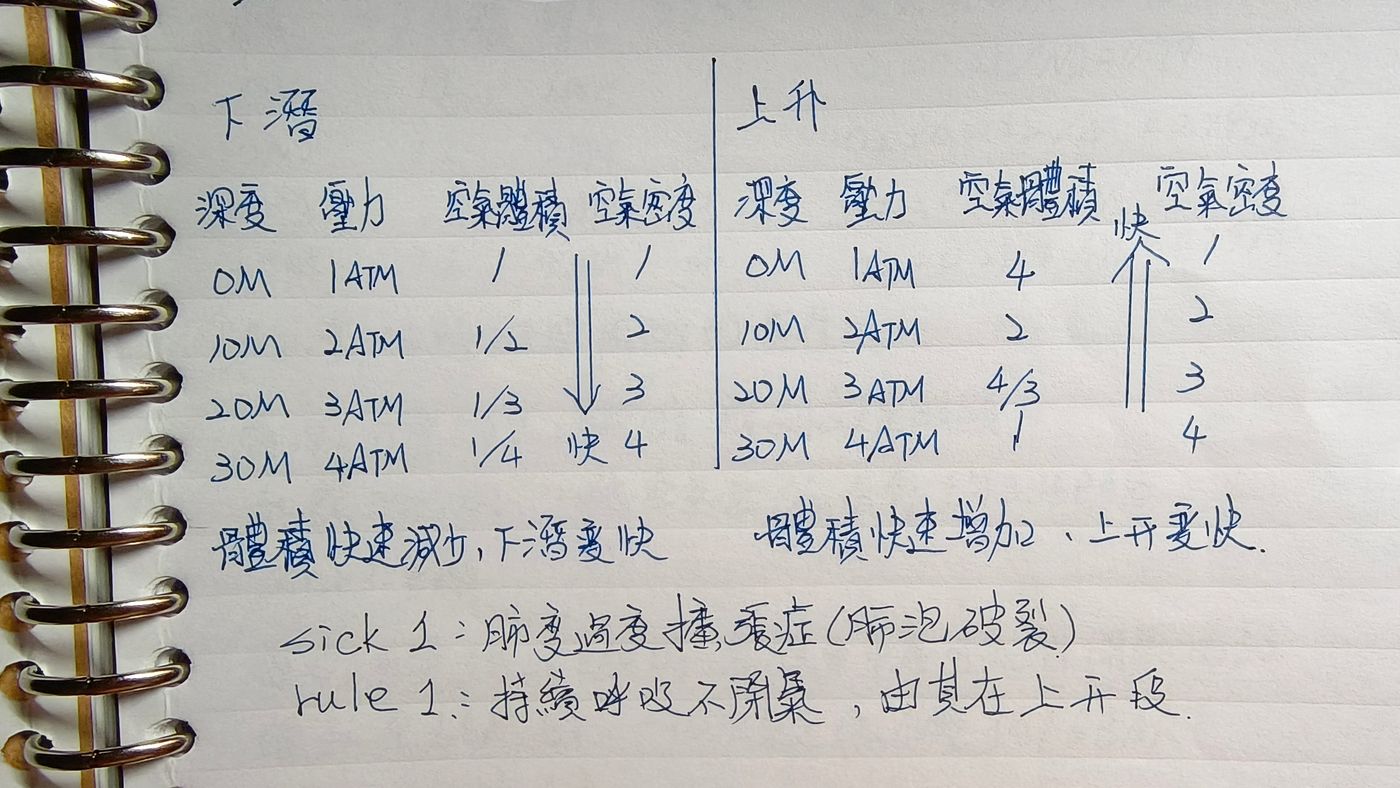
波義耳定律
英國化學家波義耳(Boyle)在1662年根據實驗結果提出在定量定溫下,理想氣體的體積與氣體的壓力成反比。 因為水是不可壓縮的流體,空氣是可壓縮的氣體。在恒溫下氣體的體積和壓力(絕對壓力)成反比。氣瓶內壓力為P1容積為V1,壓縮後變為壓力P2容積V2。所以水越深,氣體的體積就越小。 水面(1ATM)體積為1, 潛至10m(2ATM)體積為1/2, 潛至20m(3ATM)體積為1/3, 潛至30m(4ATM)體積為1/4, 潛至40m(5ATM)體積為1/5, 深度每增加10米增加一個ATM。 所以在下潛的越深,會因為壓縮使得體積漸少而導致下潛速度變快;上升的時候會因為氣體體積增加而使得上升變快。而比較大的問題會是上升的時候,上升的速度過快會容易造成減壓病的發生,而如果在上升段的時候憋氣則很容易得到肺部過度擴張症。
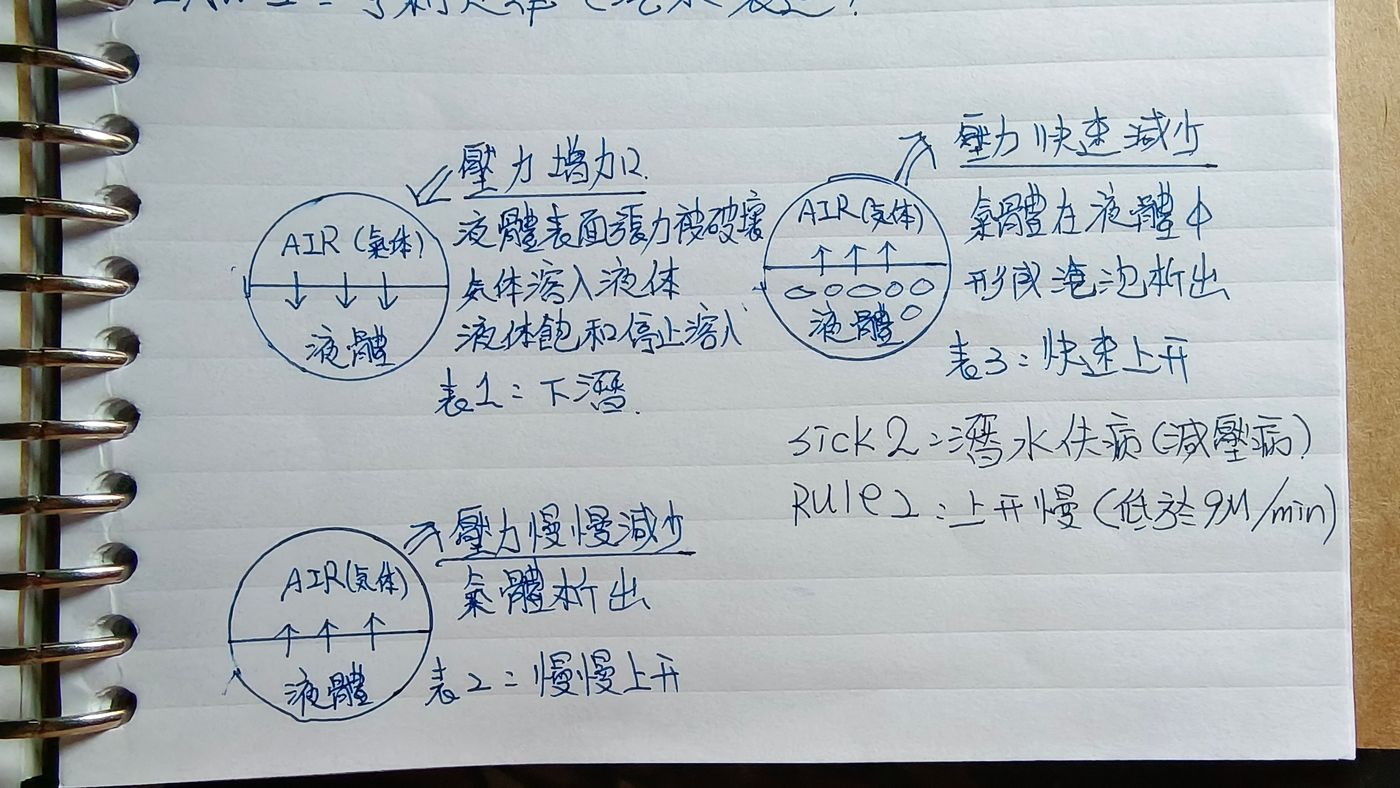
亨利定律
亨利定律是物理化學的基本定律之一,氣體有溶於液體的特性,氣體和液體接觸時溶入液體直至飽和。在一定溫度和1個大氣壓條件下,一種氣體溶解於某種液體中的毫升數稱為該氣體在那種液體中的溶解係數。溶解係數隨溫度改變,與氣體分壓成正比。 一般的空氣中有21%氧氣與79%的氮氣,在潛水的時候因為壓力會使得氮氣融入血液之中。水深增加時氮氣分壓隨之增高,氮氣溶入血液和組織的量也增多。如水深10米處為2個ATM,氮氣溶入人體的量也翻倍。
在30米深度長時間潛水,因氮分壓為1個大氣壓時的4倍,不經減壓而急速上浮,過飽和的氮氣會因壓力驟減無充分時間排出體外而在身體組織中形成游離氣泡,也就是所謂的減壓病(潛水伕病)。 所以通常在休閒(免減壓)潛水的活動都會實施五米三分鐘的減壓停留,以及一定比例的水面停留時間,確保體內餘氮不會影響人體。
道爾頓分壓定律
在溫度和體積恒定時,混合氣體的總壓力等於各組分氣體分壓力之和,各組分氣體的分壓力等於該氣體單獨佔有總體積時所表現的壓力。 0M:1ATM =》N2→0.79 Bar;O2→0.21Bar 10M:2ATM =》N2→0.79X2 Bar;O2→0.21X2Bar 20M:3ATM =》N2→0.79X3 Bar;O2→0.21X3Bar 30M:4ATM =》N2→0.79X4 Bar;O2→0.21X4Bar
氧氣O2和氮氣N2的分壓和在1個大氣壓條件下完全相等,因此不會發生氧中毒和氮醉。而當下潛的深度愈深N2的分壓就會增加,當N2分壓約3.2BAR的時候就很容易出現氮醉現象,但是氮醉的狀況因人而異,所以上AOW進階潛水課程時下深潛時,其中一個部分就是讓我們試試自己會不會有氮醉的現象。 另一個是大深度40米以下比較容易出現的狀況,當O2分壓達到約1.6BAR的時候,急性氧中毒的可能性就會明顯增加。例如水深66M的時候,一般空氣的O2分壓約為1.6BAR。這類40米以下的技術潛水就會去計算高氧的比例或氦氧混合氣體。

不過這是書上跟上課的時候的教學,一般休閒潛水都是用最保守的方式潛水,例如休閒潛水不超過30M、按照免減壓潛水的規範潛水、充足的水面停留時間等等,確保潛水是一項安全以及輕鬆愉快的活動。
然後看到以上的資訊可能會覺得很枯燥。這點就不用擔心,請把"可能會"拿掉(笑),後面有影片是上課時候的紀錄~~
喜欢我的作品吗?别忘了给予支持与赞赏,让我知道在创作的路上有你陪伴,一起延续这份热忱!


