淺談COVID-19疫苗所應用的生物科學(1/2)

COVID-19疫苗們用何種方式,保存病原體的情資?
目前COVID-19疫苗各家廠商,將COVID-19的機要情資,以不同的方式傳遞。
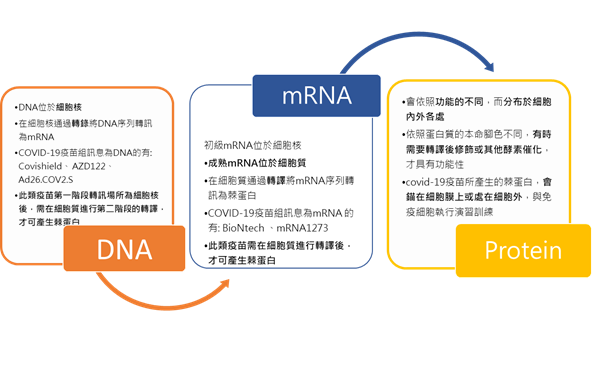
- 以DNA為傳遞資訊的腺病毒疫苗: Covishield (印度血清研所;The Serum Institute, SII)、 AZD122 (阿斯特捷利康;AstraZeneca, AZ)、Ad26.COV2.S (美國嬌生集團旗下的楊森製藥; Janssen)
- 以RNA為媒介的mRNA疫苗: BioNtech (輝瑞;Pfizer) 、mRNA1273 (莫德納;Moderna)
- 以重組蛋白質手段,來表達COVID-19棘蛋白片段的次單位疫苗: NVX-CoV2373 (諾瓦瓦克斯醫藥;Novavax)
- 將COVID-19病毒株滅活的不活化疫苗: CoronaVac (科興;Sinovac Biotech ) 、Sinopharm(國藥集團;Sinopharm)
延伸閱讀:Coronavirus disease (COVID-19): Vaccines
用DNA或RNA為訊息傳遞媒介的COVID-19疫苗,要如何將所載情資,轉訊為抗原並參與免疫演習?
不同於次單位及不活化疫苗,直接向體內提供棘蛋白的結構,且不需轉訊,直上演習場訓練;以DNA或RNA為訊息傳遞媒介的COVID-19疫苗,則是需要細胞先做轉訊情資的任務。細胞如何執行轉訊的解密任務呢?
藉由生物萬用解密程序──生物學的中心法則:
DNA(去氧核醣核酸deoxyribonucleic acid)→ mRNA 核醣核酸(ribonucleic acid)→ Protein(蛋白質)
簡述生物學的中心法則之破譯過程:
- 第一階段DNA→ mRNA
在細胞核內的DNA,通過RNA聚合酶(RNA polymerase) 協助,原物料──核糖糖酸們(A、U、C、G),執行轉錄(transcription),將DNA所載的資訊轉化成RNA。被轉錄出的RNA種類包含mRNA(信使RNA;messenger RNA)、tRNA(轉運核糖核酸;transfer RNA)、rRNA核糖體RNA(ribosomal RNA)。
其三者的腳色為:mRNA序列中,所乘載的資訊可轉訊成蛋白質;tRNA協助mRNA轉訊;rRNA會與核醣體結合,其組合為mRNA轉訊成胜肽時所需的場地。
以下,簡述mRNA的在細胞如何執行轉訊前的修飾作業。 轉錄出的初級mRNA會在細胞核內,進行轉錄後修飾,其步驟有三大項。
一,RNA剪接(RNA splicing)
RNA序列的資訊可分為,乘載轉訊情資的外顯子(Exon),以及可能具基因表達調控功能的內含子(intron)。在原則上會選擇性保留外顯子,移除序列中的內含子。但因在RNA剪接過程中,可能會選擇保留不同的外顯子片段,則產生選擇性剪接(alternative splicing)現象,也因此會輸出不同的mRNA異構物(isoform)。
二,在mRNA的五端進行加帽儀式(5’ capping)。
三、在mRNA的三端進行多腺苷酸化(3’ poly-adenylation)。
初級轉錄mRNA完成轉錄後修飾,會升級為成熟的mRNA。才會藉由細胞核上的小通道,跑出細胞核到細胞質遊蕩。
另註:具有特定功能的RNA,會在細胞質進行折疊或組裝,這些RNA具有二級結構的特性(如:tRNA、rRNA)。
- 第二階段 mRNA→peptide
已經在細胞質中mRNA,會接洽mRNA轉訊工廠──核糖體(ribosome)。在得到廠方協助後,進行媒合轉訊成胜肽的任務,以及在此招募特定的打工仔與原物料──tRNA與胺基酸(amino acid)組合。
被招募的tRNA,其自身上的反密碼子(anticodon),與mRNA上的密碼子(codon)可相互對應,而此被招募的tRNA上,會有呼應序列的特定胺基酸(amino acid)。因此藉此機制,被招募的tRNA可運送與密碼子所對應的胺基酸(原物料),到此來合成胜肽。
mRNA-tRNA藉核糖體媒合成功後,會將tRNA所帶來的胺基酸,與前一個被媒介且停留在產線上的胺基酸,用藉著肽鍵(peptide bond),將前後的胺基酸串聯。而被串聯的胺基酸們,我們稱之為胜肽(peptide)。這時,在此完成媒合任務後的tRNA,才會打卡下班,離開核糖體。
tRNA下班後,廠方(核糖體)還會再招募符合條件的打工仔(tRNA),重複上述操作。直到遇到mRNA的停止令──終止密碼子(Stop codon)。當mRNA提出提主終止轉訊要求後,核糖體的廠房才會就地解散,mRNA也會離去,再度自在的遊盪於細胞質中;其輸出的產品胜肽,亦會隨著廠房的瓦解而離去,並在細胞中執行下一階的任務。
以上所述在生物學中,稱之為轉譯(translation)──也就是RNA轉訊為胜肽的過程。
- 第三階段 peptide→ protein
被輸出的胜肽會在特定點(如:細胞質、內質網(Endoplasmic reticulum)等),進行折疊及組裝,完成蛋白質的初始型態。但非一定具有功能性。因為有些蛋白質還需要轉譯後修飾(如:醣基化(Glycosylation)、甲基化(methylation)、泛素化(ubiquitination));亦有些蛋白質需要酵素催化後,才會具有功能性。蛋白質也會因應本命的腳色的不同,分布在細胞內、錨定在細胞膜上、回歸細胞核或分泌至細胞外。
因此細胞亦會依照生物學的中心法則,將DNA或RNA疫苗所載棘蛋白的序列,在細胞內轉訊棘蛋白。
延伸閱讀:
生命科學概念| DNA與RNA
影片介紹|Types of RNA:mRNA, tRNA, and rRNA function
密碼子與胺基酸對照表|遺傳密碼 (Genetic code)
為什麼各廠商製造COVID-19的疫苗時,大多都視棘蛋白(spike protein)的次單位(subunit)為敵方的重要情資?
COVID-19除了不活化病毒疫苗的系列,給予整顆不具感染力的COVID-19;其他的疫苗們,不管是DNA、RNA,或是次單位疫苗,目前都是選用棘蛋白進行免疫演習。因為棘蛋白是促使COVID-19進入細胞內的重要角色,如同病毒的主要攻城武器!因此,選用棘蛋白為訓練標的,就是要培訓免疫細胞,有效率地瓦解COVID-19敵軍的攻城系統。
我們再進一步的來了解,棘蛋白是通過何種機制,進入細胞之中。
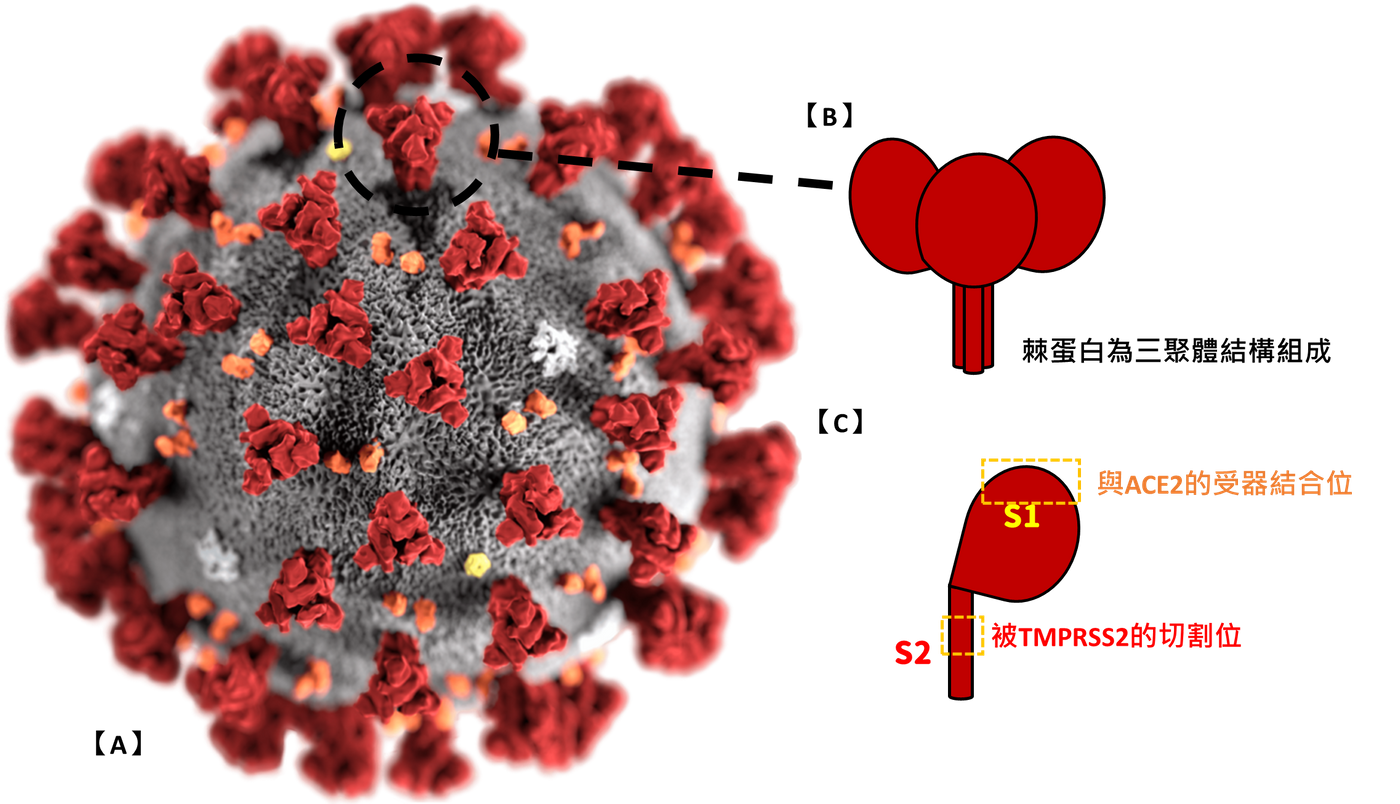
棘蛋白位於COVID-19病毒株的最外層結構,且為三聚體結構的醣蛋白。棘蛋白的結構分區,又可分為S1,及S2,兩單位都與輔助COVID-19進入細胞有關聯。
- 方法一,利用胞吞作用
S1與細胞膜上的ACE2 (血管收縮素轉化酶2;angiotensin-converting enzyme 2)結合後,利用細胞的胞吞作用,進入細胞內。 - 方法二,利用膜融合作用
當S1與細胞膜上的ACE2結合後,細胞膜上的TMPRSS2(跨膜絲胺酸蛋白酶2;Transmembrane Serine Protease 2),會針對棘蛋白上的S2進行切割,促使棘蛋白被蛋白水解(proteolysis)後,也促成COVID-19的病毒膜與細胞膜相互融,進而直接將的製造COVID-19的相關資訊輸入細胞內。
延伸Q&A
Q:COVID-19利用以上兩種方法,將何種情資輸入至被俘虜的細胞中?
A:COVID-19的正單鏈RNA(positive-sense single-stranded RNA)與核衣殼蛋白(nucleocapsid)所形成的複合物──核糖核蛋白(ribonucleoprotein)。
COVID-19的正單鏈RNA
COVID-19的RNA也會利用生物學的中心法則,藉由兩種方式命令俘虜的細胞,生產更多COVID-19。
- 方式一:
病毒的正單鏈RNA,會直接命令被俘虜的細胞提供核糖體,直接將自身的RNA所載資訊轉譯為蛋白質。所合成的病毒蛋白質,會在細胞質協助製造更多COVID-19;或組裝成COVID-19運送到細胞膜外,感染更多細胞,並勒令其作為病毒製造廠。 - 方式二:
藉由病毒RNA所製造的蛋白──RNA依賴性RNA聚合酶(RNA-dependent RNA polymerase,RdRp),將病毒所植入細胞中,少量正單鏈RNA,先轉成負鏈RNA。所新生的負鏈RNA為模板,再藉由RdRp大量合成病毒的正鏈RNA,增量其在細胞中的基數,以利細胞產生COVID-19的效率。此新合成的正鏈RNA也會透過核糖體,轉譯出更多的COVID-19蛋白,並組裝成新COVID-19,派出細胞外進行大規模的進攻。
*德納西韋(remdesivir)以抑制COVID-19的RdRp,達到抗病毒的功效。
核衣殼蛋白(nucleocapsid)
核衣殼蛋白會與病毒的RNA纏繞,以穩定RNA結構。且病毒在進行轉訊或複製RNA時,其與纏繞RNA的鬆緊度,會影響任務進行的效率(纏的越緊,效率越低;反之亦然)。此外,核衣殼蛋白還有另一項功能,藉由與病毒的膜蛋白互動,參與新合成病毒的組裝任務。
Q:為何RNA病毒的突變會較高?
A:因為所參與病毒RNA複製的RdRp,沒有校正(proofreading)功能,導致新合成的RNA容錯率較高。因此,能產生多元突變的病毒RNA序列。若錯誤率不高,且主架構在可生成COVID-19的框架下,此突變RNA序列也會進行轉訊,並合成突變COVID-19。但此機制不一定都能轉訊出高致病且感染性的病毒,病毒突變後的致病性與傳染力是天擇。
延伸閱讀
COVID-19與其棘蛋白的相關報導及研究|New coronavirus variant: what is the spike protein and why are mutations on it important?
台灣衛生福利部疾病管制署科普的影片|COVID-19 (武漢肺炎) 之病毒學解析
為何RNA病毒的突變會較高?|
Why are RNA virus mutation rates so damn high?
The coronavirus is mutating—but what determines how quickly?
Structure of replicating SARS-CoV-2 polymerase
德納西韋與COVID-19的相關研究|
Mechanism of SARS-CoV-2 polymerase stalling by remdesivir
Structural basis for inhibition of the RNA-dependent RNA polymerase from SARS-CoV-2 by remdesivir
從COVID-19候選疫苗中,以結構分析全長的COVID-19棘蛋白結構|Structural analysis of full-length SARS-CoV-2 spike protein from an advanced vaccine candidate
棘蛋白與ACE2相關研究|
Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus
Characterization of spike glycoprotein of SARS-CoV-2 on virus entry and its immune cross-reactivity with SARS-CoV
棘蛋白與TMPRSS22相關研究|TMPRSS2 and TMPRSS4 promote SARS-CoV-2 infection of human small intestinal enterocytes.
以COVID-19棘蛋白的結構,分析其潛在的抗COVID-19藥物|Structural and functional properties of SARS-CoV-2 spike protein: potential antivirus drug development for COVID-19
棘蛋白-ACE2/ TMPRSS22相關藥物開發的報導與研究|
What is the ACE2 receptor, how is it connected to coronavirus and why might it be key to treating COVID-19? The experts explain
SARS-CoV-2 S protein:ACE2 interaction reveals novel allosteric targets
SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor
棘蛋白-ACE2受體影響血管內皮細胞的相關報導與研究|
The novel coronavirus’ spike protein plays additional key role in illness
SARS-cov-2 Spike Protein Impairs Endothelial Function via Downregulation of ACE 2
目前並無直接證據顯示,棘蛋白與CD147有直接性的結合|
No evidence for basigin/CD147 as a direct SARS-CoV-2 spike binding receptor
喜欢我的作品吗?别忘了给予支持与赞赏,让我知道在创作的路上有你陪伴,一起延续这份热忱!







- 来自作者
- 相关推荐