
服務生醫產業超過25年,經歷研發/產品管理/事業開發/銷售業務/品保法規等工作,工作橫跨美國,台灣,產品經歷家用醫材/專業醫材/實驗室設備等,在這個園地貢獻自己一點經驗及想法。
語言確效 (Linguistic Validation)
根據MDR之 Annex II
— the label or labels on the device and on its packaging, such as single unit packaging, sales packaging, transport packaging in case of specific management conditions, in the languages accepted in the Member States where the device is envisaged to be sold
and
— the instructions for use in the languages accepted in the Member States where the device is envisaged to be sold
銷售到歐盟區域國家之產品,需要使用當地國家官方認可的語言。
而這個條文衍生出一個議題,就是如何確保這些翻譯到當地的語言是合適,清晰可讀的,這也是近年來認證單位一直對製造商的語言確效(Linguistic Validation)的流程非常注意的原因。
藥廠的作法
就藥廠在執行嚴謹的臨床實驗時,語言確效是基本的要求,其作法及精神參考如下文
https://www.languagescientific.com/what-is-linguistic-validation/
翻譯如下
語言確效最常用於臨床結果評估 (COA),例如患者報告結果 (PROs)、臨床醫生報告結果 (ClinROs) 和觀察者報告結果 (ObsROs) 以及生活質量 (QOL) 問卷。這些通常被稱為“工具”,包括說明、項目(也稱為問題)和反應類別或對這些項目/問題的反應選擇。
進行語言確效以確保翻譯在目標語言中陳述的內容與源語言中的原始內容相同。語言確效不僅僅是產生與原始源文檔具有同等意義的翻譯;它為每種文化提供了工具項目的構造值的等效性。
換句話說,翻譯後的問卷必須在所有語言中表現出相同的統計方式。語言驗證的最終目標是確保問卷的所有組成部分具有相同的構造值,並且在多種語言和地區之間在概念上是等效的。語言驗證是保證高價值材料翻譯質量的額外步驟。
這是一個很嚴謹的系統作法,把要表達的資訊進行解構, 定義清楚每個元件代表的意義,也就是上文所提到的構造值。
所以該工具在對應不同語言時,確認該架構上的元件都可以等效的語意傳達。
國際藥物經濟學和結果研究學會 (International Society of Pharmacoeconomics and Outcome Research,ISPOR) 就如何正確進行語言確效提出了建議。
在選擇語言服務提供商時,最重要的是找到一個遵循 ISPOR 兼容流程和方法的服務提供商。
以下為藥廠的標準作法
第 1 步:正向翻譯 (Forward Translation)
語言確效的第一步涉及至少兩名獨立的翻譯人員,他們在稱為正向翻譯的過程中將源材料翻譯成目標語言。正向翻譯應由經驗豐富的專業翻譯人員進行,他們是母語專家,也是研究領域的專家(事實上,僱用的所有翻譯人員都應如此)。
翻譯人員應該是臨床醫生、醫生、精神科醫生、社會工作者或相關的知名專家,而不僅僅是雙語人士。
第 2 步:調和 ( Reconciliation)
下一步是對正向翻譯進行比較並協調成一個結合了兩種正向翻譯的最佳版本的版本。
翻譯的協調版本應該在概念上等同於源頭。
創譯( Transcreation)可能比逐字精確翻譯更合適。
有時,準確的翻譯可能會導致目標語言的含義發生意想不到的細微變化。
協調一致的翻譯應易於用目標受眾的口語理解。
第 3 步:反向翻譯(Back Translation)
接下來,將調和後的翻譯翻譯回原始源語言。反向翻譯應由(至少)兩名未看過原始源文檔或材料的獨立、分開的譯員進行。
第 4 步:最終審核和更正翻譯(Final Review And Corrected Translation)
一旦反向翻譯完成,專案經理就會根據原始源文檔審查反向翻譯,並確定協調後的翻譯是否準確或與原件在語言上是否有效。
在這個階段,專案經理、國內調查員和/或翻譯團隊共同完成最終的更正翻譯。
一旦語言確效的這一階段完成,通常需要測試經過確效的工具,以確保目標位置的受訪者以顯示含義等價的方式解釋項目和響應。這通常通過認知匯報(Cognitive debriefing)來完成。
第5步:認知匯報(Cognitive debriefing)原則上是在目標人群和目標語言群體的代表中測試問卷或其他評估的過程。 理想情況下,這發生在面對面的採訪中。
目的是驗證問卷中所有項目的翻譯在目標人群和區域中的理解方式相同。 美國FDA要求進行認知匯報,以顯示所有提交翻譯的內容有效性.[註1]
整個程序(Fig 1)若採用醫材的開發流程架構觀之,前三步驟的翻譯,類似產品開發,或可認為開發某種語言版的標示(labeling),如手冊(IFU),第4步就是驗證(verification),如確認沒有錯誤,架構是正確的,第5個步驟則是確效(Validation),找幾位使用者做測試或是面談,確認這個翻譯在當地是可被清晰了解,無任何誤會的。
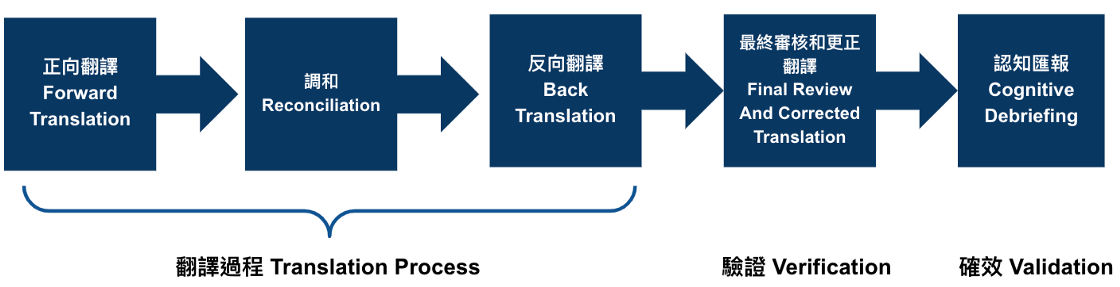
整個架構與醫材的開發流程架構精神上雷同。
實務運作探討
大部分的醫材公司的資源是有限的,以上流程的費用,光是三個翻譯流程的價格會是一般翻譯服務的3~5倍,第4部驗證可以等同一般翻譯的校對(proof-reading),而第五步又是一筆費用。
所以大部分的醫材公司是無法承受的負擔。但法規的要求又必須遵守。
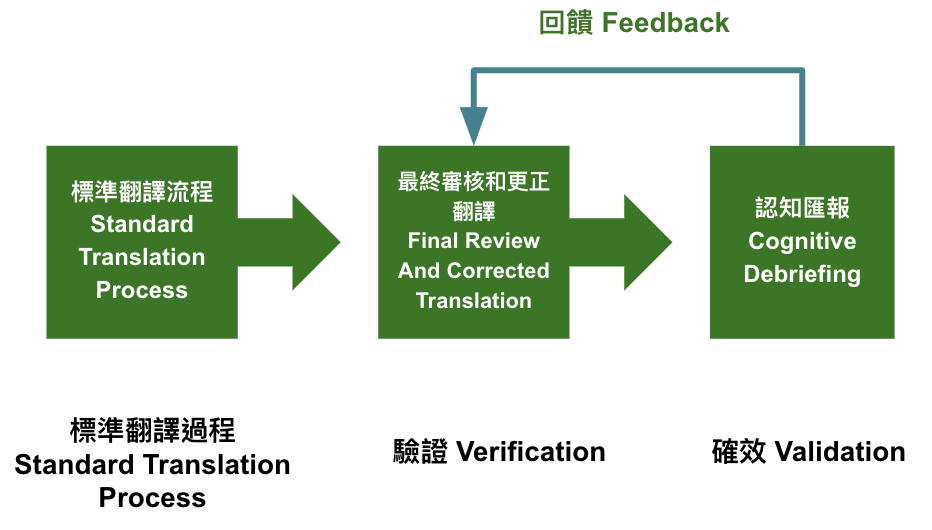
就個人的經驗,提出如Fig 2的簡化流程,可採用標準翻譯程序,本流程的重點在於以確效把關,如果確效過程發現有問題的地方則回饋修正,直到成功確效。
相關原則如下
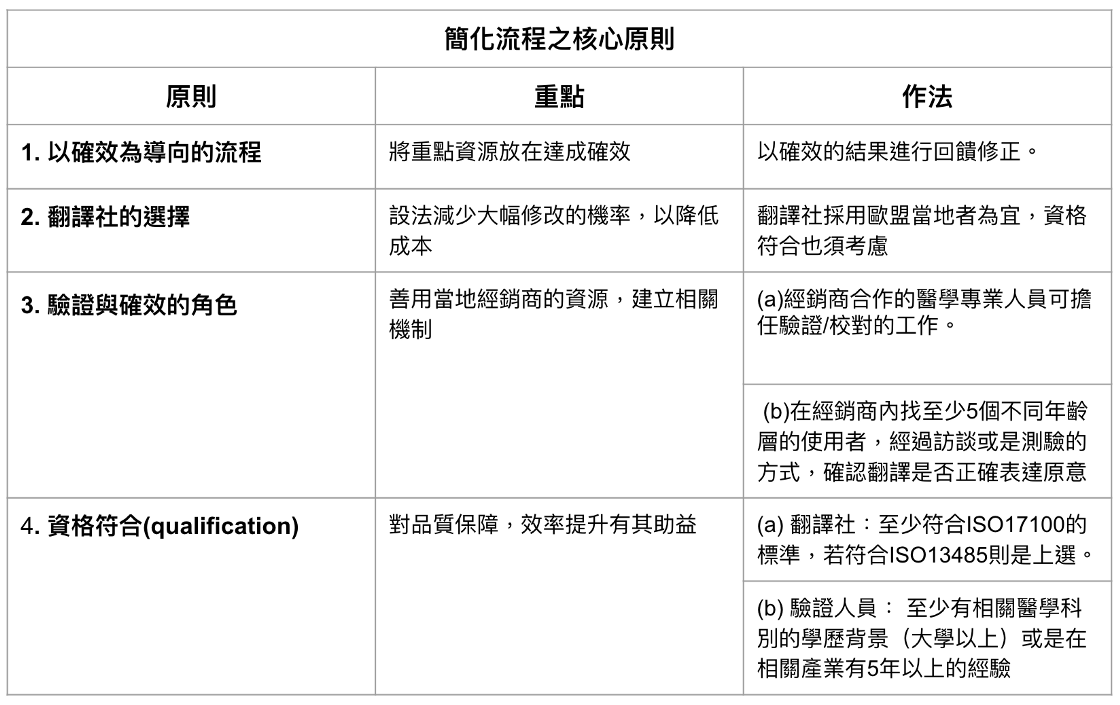
1. 以確效為導向的流程:目前法規上尚未對語言確效明定流程,但基本上reviewer要看到的是語言被確效的證明,以及相關流程。
所以可將重點資源放在達成確效,以確效的結果進行回饋修正。
2. 翻譯社的選擇:實務上,翻譯社採用歐盟當地者為宜,目地是設法減少大幅修改的機率,以降低成本。另外,第4點談到的資格符合也是要點。
3. 驗證與確效的角色:通常要銷售某些非英語系的國家,是來自當地特定的需求,故可善用當地經銷商的資源,建立相關機制。例子如下
(a)因為銷售醫材的經銷商通常會有醫學方面的合作夥伴或是顧問,有些甚至有合作醫生,所以這些合作的醫學專業人員可以擔任驗證/校對的工作。
(b)驗證/校對後,可在經銷商內找至少5個不同年齡層的使用者,經過訪談或是測驗的方式,確認翻譯是否正確表達原意,而過訪談或是測驗的資料,則保留交給製造商,作為確效的依據。
4. 資格符合(qualification):雖然流程沒有明定,但筆者認為訂定資格符合的規範對品質保障,效率提升是有其助益。建議如下
(a) 翻譯社:至少符合ISO17100的標準,若符合ISO13485則是上選。
(b) 驗證人員: 至少有相關醫學科別的學歷背景(大學以上)或是在相關產業有5年以上的經驗
本概念以Table 1 表示
小結
以上作法為經驗上的參考,但原則上就是以達成被認證單位認可的確效報告及流程為基礎。而翻譯手法的效率也可從長久建立被認可的資料庫著手,以提高成功確效的勝算。
此外,採用藥廠的作法,建立一個架構清楚的語言表示手法,第一次花大錢打下基礎,而後在以此基礎產生的譯作,就直接專注在以確效為導向的簡化流程,也是一個可以考慮的作法。
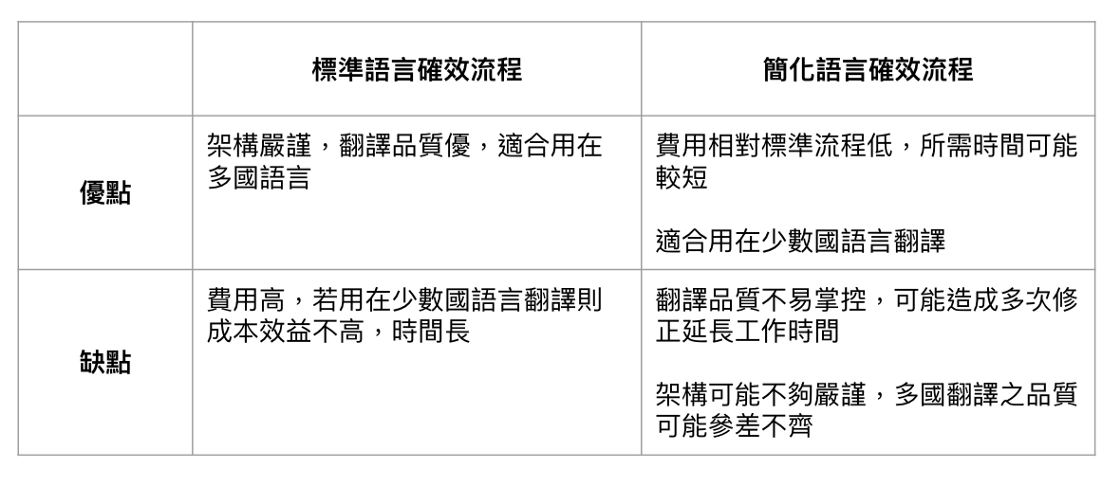
最後Table 2就標準及簡化作法做個比較。 沒有那個方式是最好的,應該是情況選擇最適合的手法。
喜欢我的文章吗?
别忘了给点支持与赞赏,让我知道创作的路上有你陪伴。
发布评论…